Абстракт
Было показано, что и гиалуроновая кислота (ГК), и гиалуронидаза (ГКаза) присутствуют в большом количестве во внеклеточном матриксе (ВКМ) раковых опухолей. Поскольку ГК с высокой молекулярной массой (в-ГК) является антиангиогенной, а ГК низкой молекулярной массы (н-ГК) является ангиогенной, то ГКаза может играть важную роль в регулировании в-ГК/н-ГК баланса. Детальное исследование кинетики гидролиза ГК, катализируемой ГКазой может таким образом быть полезным, чтобы понять его значение в развитии рака, и должно быть исследовано in vitro через модельную систему.
Кинетика была проверена методом Рейссига (улучшенным в нашей лаборатории), который оценивает число сокращения концов, сформированных гидролизом ?(l-4) гликозидных связей. Мы исследовали эффекты концентраций и субстрата, и фермента, а также ионной силы на кинетику. Самые оригинальные результаты касаются нелинейной формы временной зависимости и нетипичного поведения начальной нормы против концентраций субстрата и фермента. Кривая зависимости субстрата, кажется, имеет тип кривой Михаэлиса только для низких концентраций. Существенное уменьшение в начальной оценке наблюдается для более высоких концентраций, которые предполагают появление ингибирования. Чтобы объяснить наши экспериментальные результаты, мы должны полагать, что ферментативная деградация полисахарида - специфический случай ферментативных реакций из-за полимерной природы основания. Разработка кинетического моделирования, в согласии с экспериментальными результатами, позволяет нам сделать несколько предположений о механизме реакции.
Ключевые слова
Гиалуронан, гиалуронидаза, ферментативный гидролиз, кинетика, оценка восстановленных концов, субстратная зависимость, ферментная зависимость.
Введение
Гиалуронан (ГК) - линейный отрицательно заряженный полисахарид, составленный из D-глюкуроновой кислоты-?(l, 3)-N-ацетил-D-глюкозамин дисахаридных единиц, связанных между собой ?(l, 4). ГК присутствует и в микроорганизмах, и в позвоночных животных и является одним из главных компонентов внеклеточного матрикса (ВКМ) животных более высокого порядка. Его размер колеблется от нескольких сотни тысяч до десяти миллионов Дальтон согласно его происхождению. ГК - это главный субстрат для гидролитических ферментов, названных гиалуронидазами (ГКазы). И лизосомальные, и тестикулярные ГКазы (E.C. 3.2.1.35) гидролизуют ?(1,4) гликозидные связи, производя фрагменты ГК с N-ацетил-D-глюкозамином на восстановленном конце.
Несколько методов были описаны, чтобы оценить деятельность ГКазы: турбидиметрия, вискозиметрия, метод ELISA, хроматография HPLC и колориметрические методы. Колориметрический метод Рейссига и др, использовался главным образом для того, чтобы исследовать деятельность ГКаз, и большинство авторов оценивает деятельность, измеряя общее количество восстановленных, произведенных реакцией после определенного времени инкубации, обычно от 10 минут до 2 часов. Однако, из-за нелинейной формы кинетики, деятельность фермента должна быть оценена начальной нормой производства восстановленных концов.
Здесь мы интересуемся кинетикой ГК-ГКазной реакции, и метод Рейссига является особенно подходящими, так как он непосредственно норму разрыва гликозидных связей. Определение начальной нормы реакции позволяет нам изучать влияние концентраций субстрата и фермента.
Материалы & методы
Бычий тестикулярный фермент ГКаза со специфичной активностью 990 единиц на мг был получен от Sigma (H 3884). Гиалуронат натрия (ГН), выделенный из бычьей трахеи был получен от Fluka (Номер 366047/1). ГК и ГКаза использовались без дальнейшей очистки. Для использования метода Рейссига необходимо два раствора: 1. Раствор бората, приготовленный растворением 4.94 г борной кислоты и 1.98 г гидроокиси калия в воде Milli-Q на 100 мл воды, 2. 0.1 г/л раствор ДМАБ (диметилбензальдегид), приготовленный растворением 5 г ДМАБ (Sigma D 8904) в 6.25 мл 12 Н соляной кислоты, с добавлением ледяной уксусной кислоты к заключительному объему 50 мл. Разведение 1/10 этого раствора ледяной уксусной кислотой было выполнено как раз перед использованием.
Спектр поглощения был измерен на спектрофотометре Uvikon 860 Kontron, оборудованном контролируемой температурной ячейкой и соединенном с ПК. Измерение активности ГКазы основано на методе Рейссига, который определяет концентрацию свободного от ГК восстановленного P-N-ацетил-D-глюкозамина. При этом ?-N-ацетил-D-глюкозамин (Sigma 8625) использовался как стандарт. Раствор ГК, содержащий 5 mM ацетат аммония, pH 5, помещен в реактор, приспособленный к выбранному значению pH, с уксусной кислотой или с раствором аммиака, при перемешивании и контролируемом значении температуры 37 °C. Реакция была начата добавлением сконцентрированного раствора фермента ГКазы. В каждой контрольной точке аликвоту в 200 мкл реагирующей смеси забирали из реактора и добавляли 50 мкл раствора бората в стеклянной трубе. Труба немедленно перемешивалась, нагревалась в ванне с кипящей водой в течение ровно 3 минут, затем помещалась в холодную водную ванну (приблизительно 10°C), пока не забирали 10 определенных аликвот. Затем 1.5 мл разведенного раствора ДМАБ было добавлено к каждой пробе. Содержимое быстро перемешивали и помещали на 37°C в течение ровно 15 минут. Затем раствор анализировали, поместив его в пластмассовую кювету с толщиной стенки 1 см, сканировали от 400 до 700 нм, записывая спектр на компьютере.
Результаты & обсуждение
Следуя временной зависимости концентрации восстановленных концов в различных условиях содержания ГК и ГКаз, нелинейные формы наблюдались в случае выравнивания по биэкспоненциальной кривой. Активность ГКазы была тогда определена, измеряя норму реакции в ноле времени.
Влияние концентрации субстрата
Активность ГКазы была измерена для различных концентраций ГК в пределах от 0.1 до 3 мг/мл. Наблюдалась нетипичная кривая субстратной зависимости (рис. 1).
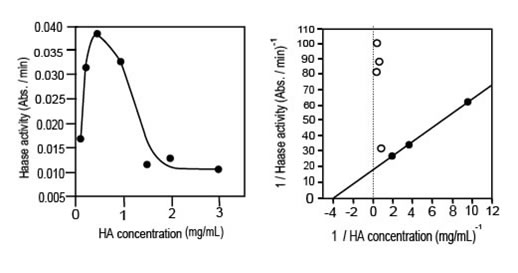
Иллюстрация 1. Зависимость активности ГКазы составляла заговор от концентрации ГК (левая кривая) и линеаризация Лайнвевера-Бурка (правая кривая). Реакции проводились при 37°C и pH 5. Концентрация ГКазы составляла 2 мг/мл.
При низких концентрациях ГК наблюдается классическое увеличение активности ГКазы, тогда как при высокой концентрации ГК она падает и стабилизируется на низком уровне. Кинетика не подчиняется уравнению Михаэлиса-Ментен. Однако, появившиеся константы Vm и Кm могут быть определены для низкого значения концентрации ГК, но только Кm (0.25 мг/мл), может иметь определенное значение. Относительно высоких концентраций ГК могут быть предложены три гипотезы:
1. Вязкость раствора препятствует распространению фермента
2. Изменения в конформации ГК препятствуют взаимодействию ГК-ГКаза
3. Существуют явления ингибирования.
Влияние концентрации фермента
Активность ГКазы была тогда измерена для различных концентраций ГКазы в пределах от 0.25 до 5 мг/мл. Так же, как и в случае субстрат-зависимой кривой, была получена нетипичная зависимость для фермента. Наблюдалась кривая сигмоидальной формы (рис. 2) с очень низкой активностью ГКазы, ниже l мг/мл. Это поведение может интерпретироваться как переход между низким уровнем и режимами высокого уровня, которые могут использоваться для регулирующих механизмов ВКМ. Эти наблюдения согласуются с гипотезами, предложенными выше.
Заключение
Принимая во внимание, что большинство авторов оценивает активность фермента, измеряя полное количество восстановленных концов, произведенных реакцией после данного времени инкубации, мы следовали по всему интервалу времени производства восстановленных концов и вывели активность ГКазы из нормы в ноле времени. Самые оригинальные результаты касаются нетипичного поведения начальной нормы против концентраций субстрата и фермента. Зависимость субстрата, кажется, имеет тип кривой Михаэлиса только для низких концентраций. Существенное уменьшение в начальной норме наблюдается для более высоких концентраций. Сигмоидальная зависимость фермента может интерпретироваться как переход между низким уровнем и режимами высокого уровня. Ферментативный гидролиз ГК является специфическим случаем ферментативных реакций из-за полимерной природы субстрата:
1. Структура и конформация субстрата могут очень влиять на геометрию активного участка фермента
2. Неспецифичные взаимодействия, которые могут также происходить между ферментом (белок) и субстратом (полисахарид).
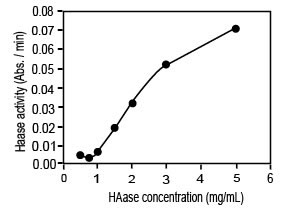
Иллюстрация 2. Зависимость активности ГКазы от концентрации ГКазы. Реакции были проведены при 37°C и pH 5. Концентрация ГК составляла 1 мг/мл.
Это нетипичное поведение может вызывать регуляторные феномены в ВКМ, в особенности в случае раковых опухолей.
Благодарности
Мы благодарим доктора Б.Делпеш и P.Бертран за полезные обсуждения. Мы благодарны Conseil Regional de Haute Normandie за партнерство.