Абстракт
У гиалуронана (ГК) есть большой потенциал в медицине как у биоматериала. Однако, в его нативной форме, ГК быстро усваивается в естественных условиях in vivo свободными радикалами и ферментами, такими как гиалуронидаза, к тому же обладает очень высокой растворимостью. Поэтому были опробованы различные методы, чтобы изменить физико-химические свойства ГК, поддерживая биологическую совместимость, и таким образом расширить ее спектр терапевтических действий.
У гиалуронана есть четыре реактивных центра (ацетамид, карбоксил, гидроксил и восстановленный конец) доступные для кросслинкинга самим себе или другим полимерам. Используя множество агентов кросслинкинга, исследователи выявили совокупность производных кросслинкинга ГК с увеличенным in vivo временем жизни (устойчивости). Эта химическая модификация позволила производство гелей и пленок, которые могут использоваться в терапии, такой как предотвращение постхирургического прилипания, заживления ран и кожных увеличений.
Мы выяснили, что если ГК поперечно связывается сам с собой или с другим полимером (или синтетическим, или биополимером), в две стадии, то высокая степень кросслинкинга достигнута с улучшением биостабильности. В каждой из этих двух стадий используется то же самое вещество кросслинкинга, но различные функциональные группы связываются, изменяя условия реакции. Новый процесс может быть произведен, чтобы получить нерастворимый в воде гель или пленку с широким диапазоном физических и химических особенностей и большим сопротивлением деградации гиалуронидазой и свободными радикалами. Эти производные в настоящее время подвергаются тестированию биологической совместимости и должны, в конечном счете, привести к ряду инновационных медицинских продуктов второго поколения.
Ключевые слова
Гиалуронан, кросслинкинг, биосовместимость, производные гиалуронана, матрица ГК-полимера.
Введение
Гиалуронан (гиалуроновая кислота; гиалуронат натрия), сокращенно ГК, был сначала обнаружен Мейером и Палмером в 1934. Гиалуронан - длинный линейный полисахарид, состоящий из повторяющихся дисахаридных единиц N-ацетилглюкозамина и D-глюкуроновой кислоты. У молекулы есть уникальные реологические свойства, которые позволяют этому полимеру вести себя как вязкоупругому гелю даже при низких концентрациях.
Гиалуронан широко распределен всюду в теле и формирует капсулу у некоторых бактериальных разновидностей. Он найден в особенно высоких концентрациях в стекловидном теле глаза, синовиальной жидкости суставов и пуповины. Как один из существенных элементов внеклеточного матрикса, ГК в комбинации с коллагеном, хондроитин сульфатом и другими глюкозаминогликанами в состоянии поддержать рост ткани и клетки. Вязкоэластичная и гидрофильная природа ГК позволяют этому полимеру сохранить тонус и эластичность ткани, в которую он включен. Кроме того, ГК действует как смазка, когда он присутствует в жидкостях тела и может поддержать форму полостей тела, когда необходимо. Эти физико-химические свойства вместе с биологической совместимостью и неиммуногенной природой молекулы ГК позволяют использовать её в широком диапазоне клинических применений.
ГК привлекает всё более увеличивающееся внимание, как биологически совместимый гидрогель, который используется в контролируемой доставке лекарственных препаратов, при заживлении ран, предотвращении постхирургического прилипания, исправлении кожных уродств, таких как сплющенные шрамы и морщины а также для увеличения мягких тканей. ГК является биологически саморазрушающимся и легко разрушается in vivo из-за действия фермента гиалуронидазы и свободных радикалов. Это ограничивает его использование в некоторых медицинских препаратах, которые требуют длительного эффекта. Поэтому, увеличивая время жизни устойчивого ГК и расширяя область ее потенциального применения, существенно то, что нужно изменять ГК, сохраняя ее биологическую совместимость.
Изменение структуры ГК может быть достигнуто через химическую модификацию. Это может быть разделено на химическое ветвление и химический кросслинкинг. Частичная или полная эстерификация ГК может быть произведена путем химической реакции группы карбоксила полимера со спиртом. Через такую модификацию увеличивается время жизни материала, и свойства могут быть определены степенью эстерификации. Химический кросслинкинг обычно используется, чтобы произвести сильные гидрогели, используя кросслинкеры, такие как дивинил сульфон, глицидиловый эфир, полиэпоксид и глутаровый альдегид. Биостабильность и другие физические свойства поперечно связанной ГК были улучшены путем кросслинкинга гидроксильных групп на ГК полимере. Об использовании растворимого в воде карбодиимида также было известно в случае кросслинкинга ГК через реакцию между карбоксильной и гидроксильными группами ГК или доступные аминогруппы. ГКА, как сообщали, реагировал с синтетическими полимерами и биополимерами, чтобы сформировать конъюгаты. Мы выяснили, что сеть поперечно связанных молекул ГК может быть построена через кросслинкинг между карбоксил/карбоксил и между гидроксил/гидроксил группами ГК или ГК/полимер комбинациями, которые мы называем двойной кросслинкинг технологией, как показано на иллюстрации 1. Согласно этой технологии, на первой стадии устойчивые эфирные соединения получены через кросслинкинг гидроксильных групп. Второй шаг вовлекает синтез эфирных соединений, полученных кросслинкингом через карбоксильные группы. Мы выбрали другие полимеры, такие как неионогенный синтетический поливиниловый алкоголь (ПВА) и ионный биополимер альгинат натрия, для комбинации с ГК, чтобы выполнить нашу двойную кросслинкинг-технологию. Этот новый процесс позволил произвести ГК и ГК/полимер производные с улучшенной биостабильностью.
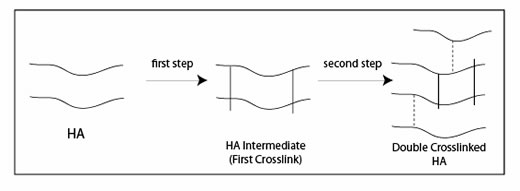
Иллюстрация 1. Схема нового процесса двойного кросслинкинга ГК.
Материалы & методы
Синтез поперечно связанного ГК
Раствор ГК (10 %) был приготовлен в 0.25 M NaOH. Был добавлен агент кросслинкинга эпихлорогидрин или 1,2,7,8-диэпоксиоктан, и реакция была выполнена в чашке Петри. После 72 часов сушки в вытяжном шкафу при комнатной температуре был получен сухой листоподобный материал. Этот материал упоминается как промежуточное звено кросслинкинга ГК. Высушенный лист был нейтрализован раствором HC1 и очищен промыванием ацетоном/деионизирированной H2O (7/3 (v/v)), IPA/деионизирированной H2O (7/3 (v/v)) и IPA. Таким образом, были получены первые интермедиаты кросслинкинга ГК. Интермедиат был подвергнут второму шагу кросслинкинга, растворяя его в ацетоне/HCl (7/3 (v/v)) при pH < 4.0. Также был добавлен агент кросслинкинга, 1,2,7,8-диэпоксиоктан. Условия кросслинкинга показаны в таблице 1. После кросслинкинга в течение 24 часов, продукт был промыт с IPA, IPA/деионизирированной H2O (7/3 (v/v)), IPA и ацетоном. Образцы были высушены, чтобы получить постоянный вес.
|
First crosslink |
Second crosslink |
|||||||
|
Sample |
Crosslinker |
Feeding
ratio |
Time (hr) |
pH |
Crosslinker |
Feeding
ratio |
Time (hr) |
pH |
|
CHA-1 |
E-1 |
0.375/1 |
72 |
OH- |
/ |
/ |
/ |
/ |
|
CHA-2 |
E-1 |
0.375/1 |
72 |
OH- |
E |
0.5/1 |
24 |
H+ |
|
CHA-3 |
E |
0.375/1 |
72 |
OH- |
/ |
/ |
/ |
/ |
|
CHA-4 |
E |
0.375/1 |
72 |
OH- |
E |
0.5/1 |
24 |
H+ |
Таблица 1. Синтез поперечно связанной ГК (ПСГК) в растворе ГК через ГК интермедиаты.
E-l: эпихлорогидрин (Aldrich); E: 1,2,7,8-диэпоксиоктан (Aldrich); Кормовой коэффициент: отношение веса ГК к кросслинкеру. Все реакции были выполнены при комнатной температуре.
Синтез поперечно связанного ПВА/ГК (ПСПГ)
1 % раствор ГК и 5%-ый ПВА водный раствор были приготовлены соответственно. Растворы были смешаны вместе, чтобы получить гомогенный ГК/ПВА раствор с различным составом ГК, как изображено в таблице 2. Раствор было оставлен в чашке Петри и высушен в вытяжном шкафу в течение 4 дней. Получающаяся пленка была обработана смесью CHC13/кислый или щелочной раствор/кросслинкер (1,2,7,8-диэпоксиоктан или глутаровый альдегид). Реакция кросслинкинга была выполнена при комнатной температуре для строго зафиксированного периода времени в 24 часа. Дальнейшее количество агента кросслинкинга было добавлено, и в случае необходимости был подведен pH фактор. Вторая реакция кросслинкинга продолжалась в течение 24 часов при комнатной температуре. Детальные условия кросслинкинга показаны в таблице 2. После кросслинкинга образцы были промыты с IPA и ацетоном три раза и затем выдержаны в IPA/деионизирированной H2O (3/2 (v/v)) на ночь при температуре комнаты. В конце пленка была промыта ацетоном и высушена в термошкафу при 37°C, пока не был достигнут постоянный вес.
Таблица 2. Формирование поперечно связанного ПВА/ГК (ПСПГ)
|
Samples |
HA (%) |
Crosslinker
1st/2nd |
pH
1st/2nd |
Time
1st/2nd |
WAC (%) |
|
CPH-2 |
10% |
E/E |
OH- |
24h/24h |
280 |
|
CPH-3 |
10% |
E/E |
H+/ OH- |
24h/24h |
340 |
|
CPH-4 |
10% |
E/E |
OH-/ H+ |
24h/24h |
250 |
|
CPH-6 |
20% |
G/E |
H+ |
24h/24h |
600 |
|
CPH-7 |
20% |
E/E |
H+/ OH- |
24h/24h |
580 |
|
CPH-8 |
20% |
E/E |
OH-/ H+ |
24h/24h |
480 |
|
CPH-13 |
50% |
E/E |
OH-/ H+ |
24h/24h |
258 |
|
CPH-1 |
10% |
G |
H+ |
24h |
300 |
|
CPH-5 |
20% |
G |
H+ |
24h |
dissolved |
|
CPH-9 |
30% |
G |
H+ |
24h |
dissolved |
|
CPH-10 |
50% |
G |
H+ |
24h |
dissolved |
|
CPH-11 |
50% |
E/E |
OH- |
24h/24h |
3117 |
|
CPH-12 |
50% |
E/E |
H+ |
24h/24h |
1084 |
E: 1,2,7,8-диэпоксиоктан; G: глутаровый альдегид; Н+ соответствует pH в окрестности 4; ОН- соответствует pH около 10; ПСПГ-1,5,9,10,11,12 все были приготовлены, используя один шаг кросслинкинга в сравнительных целях; WAC (%): Водная поглотительная способность (%)
Синтез поперечно связанной ГК-альгинатной пленки
Водный 2%-ый раствор альгината натрия был смешан с 1 % раствором ГК в фосфатном буфере, чтобы получить ГК-альгинатный раствор. Затем налили 10 мл этого гомогенного раствора в чашку Петри и добавили раствор СаСl2. Получающаяся ГК-альгинатная пластинка была промыта три раза с деионизированной H2O и была оставлена высыхать в сухожарном шкафу в течение 72 часов. Получающаяся пленка была помещена в растворяющий/спиртовой раствор, и 1,2,7,8-диэпоксиоктан был добавлен для первого этапа кросслинкинга, продолженного при комнатной температуре. Получающаяся пленка была вымыта с IPA/ деионизирированной H2O, процесс был приостановлен в кислом растворителе и дальнейшем объеме кросслинкера 1,2,7,8-диэпоксиоктана, добавленном, чтобы шел второй кросслинкинг. Детальные условия кросслинкинга показаны в таблице 3. Поперечно связанная пленка была вымыта с раствором ацетоном/деионизирированной H2O (3/2 (v/v)) три раза, затем три раза с IPA/деионизирированной H2O (3/l (v/v)). Пленка была погружена в раствор IPA/ деионизирированной H2O и оставлена на ночь, после чего её высушили в вытяжном шкафу.
Таблица 3. Формирование двойных поперечно связанных ГК-альгинатов (ПСГКА)
|
Samples |
HA (%) |
Crosslinker
1st/2nd |
Ca2+Concn
(M) |
Times (hr) 1st/2nd |
WAC (%) |
|
CAH-1 |
90 |
E/E |
0.25 |
24/24 |
2543 |
|
CAH-2 |
90 |
E/E |
0.5 |
24/24 |
3342 |
|
CAH-3 |
50 |
E/E |
0.25 |
24/24 |
908 |
|
CAH-4 |
50 |
E/E |
0.5 |
24/24 |
1449 |
Характеристика поперечно связанной ГК
A. 13C-ЯМР характеристика в твёрдой фазе
Твердофазный 13C-ЯМР анализ поперечно несвязанной ГК и двойной поперечно связанной ГК был выполнен на частоте 50 МГц, используя преимущественно 200 спектрометр. Спектры были получены, используя время контакта 1 мс в стандартной перекрестной поляризации (ПП) импульсной последовательности.
B. Измерение водной поглотительной способности
20 мг (сухой вес, Wd) каждого высушенного поперечно связанного образца были погружены в буферизованный солевой раствор фосфата (ПБС) в течение 24 часов, чтобы получить полностью раздутый гель. Влажный гель был фильтрован, и остаточная вода с поверхности удалена, используя тонкую бумагу без волокон. Влажный гель был взвешен, чтобы получить величину Ws. Таким образом, водная поглотительная способность (WAC, %) была вычислена согласно формуле (1):
WAC (%) = (Ws -Wd)/Wd * 100 (1)
C. Оценка биостабильности поперечно связанной ГК in vitro
1. Устойчивость к гиалуронидазе
20 мг поперечно связанной ГК были помещены в 6 мл раствора ПБС (pH=7.4) содержащий 1000 единиц гиалуронидазы и инкубированы при 37°C в течение 24 часов. Пленка была удалена и прополоскана, используя раствор ПБС. Растворы для полоскания и инкубации были доведены до нужного объема и вскипячены в течение 30 минут, чтобы ускорить действие гиалуронидазы. Раствор центрифугировался, а супернатант разбавили до 25 мл, используя ПБС. Концентрация ГК была измерена, используя карбазольный метод. Раствор гиалуронидазы без поперечно связанных молекул ГК был отобран как контроль. Потеря веса (%) ГК из-за активности гиалуронидазы была вычислена, используя формулу (2):
Потеря веса ГК (%) = [ГК]*25/[ГК]o * 100 (2)
где [ГК] (мг/мл) – это концентрация ГК, [ГК]o – начальное содержание ГК (мг).
2. Устойчивость к свободным радикалам
Реактивы Фентона использовались, чтобы создать свободные радикалы, которые были сформированы добавлением 25 мкл 0.1 М H2O2 и 25 мкл 0.1 М аскорбиновой кислоты на 5 мл раствора ПБС. Инкубация продолжалась в течение 24 часов при 37°C. После чего пленка была удалена и прополоскана, используя раствор ПБС. Растворы для полоскания и инкубации были сделаны из расчета, чтобы получить 10 мл раствора. Концентрация ГК была измерена, используя карбазольный метод. Раствор реактив Фентона/ПБС без поперечно связанной ГК был отобран как контроль. Потеря веса ГК (%), произошедшая из-за свободнорадикальной деградации, была вычислена, используя вышеупомянутую формулу (2).
Результаты и обсуждение
Воднопоглощающая способность (% WAC) поперечно связанной ГК
Как для гидрогеля, измерение водной поглотительной способности для поперечно связанной ГК часто используется как индекс для оценки степени кросслинкинга. Обычно, увеличение степени кросслинкинга приводит к сокращению способности поглощения воды. Чтобы оценить эффективность нашей технологии двойного кросслинкинга, была измерена водная поглотительная способность поперечно связанной ГК или ГК/полимер. Иллюстрация 2 и таблица 2 дают WAC (%) результаты для образцов после единственного и двойного кросслинкинга.
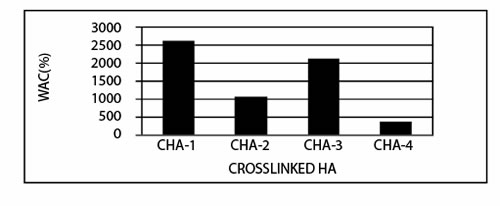
Иллюстрация 2. Способность поглощать воду (WAC, %) поперечно связанной ГК
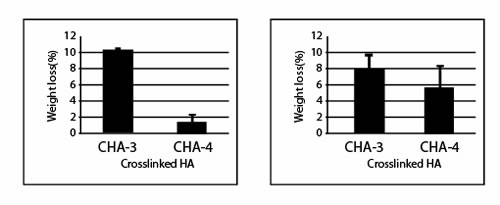
Иллюстрация 3. Устойчивость к гиалуронидазе
Иллюстрация 4. Устойчивость к свободным радикалам
Иллюстрация 2 показывает, что водная поглотительная способность уменьшена после второго кросслинкинга. Та же самая тенденция наблюдается, когда ГК объединена с ПВА. Как показано в таблице 2, единственный кросслинкинг может только произвести любые растворимые в воде продукты (CPH-5, 9,10) или продукты, усваиваемые водой (CPH-11 и 12). Напротив, двойной кросслинкинг может произвести водонерастворимые гидрогели с различными водными поглотительными мощностями, которые связаны с составом ГК и с условиями кросслинкинга. По сравнению с их единственными поперечно связанными копиями водная усваиваемость двойных поперечно связанных гелей значительно ниже. Комбинация ГК и альгината натрия, как выяснили, была под влиянием присутствия ионов кальция, которые увеличили водную поглотительную способность сформированного геля (таблица 3). Увеличение концентрации иона кальция может уменьшить реактивность карбоксильной группы из-за ионного комплексообразования, которое может оставить карбоксильную группу свободной для того, чтобы поглотить больше воды (таблица 3).
Исследование биостабильности in vitro
Деградация молекул поперечно связанной ГК и ГК/полимер при помощи гиалуронидазы и свободных радикалов были отобраны для того, чтобы определить стабильность in vitro. Результаты, показанные на иллюстрациях 3 и 4, указывают, что технология двойного кросслинкинга может произвести значительно более устойчивую сеть поперечно связанной ГК. Объединение других полимеров в пределах сети ГК может произвести материалы с различными физическими свойствами и способностью к разложению микроорганизмами.
13C-ЯМР характеристика поперечно связанной ГК в твёрдой фазе
Иллюстрации 5 и 6 отображают твердофазные спектры 13C-ЯМР поперечно несвязанной ГК и ГК после двойного кросслинкинга. Это показывает присутствие моста метилена длинной цепи (20-40 ппм) в сети поперечно связанной ГК. Кроме того, химическое изменение в 165-170 (плечо) указывает на формирование этерификационных соединений.
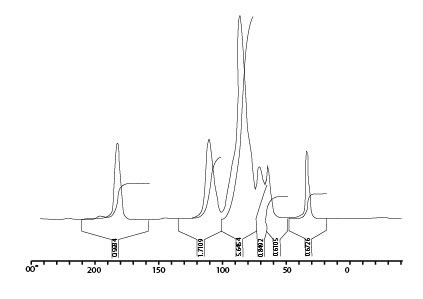
Иллюстрации 5. Твердофазный 13C-ЯМР спектр ГК
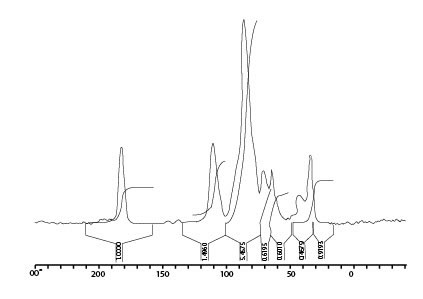
Иллюстрация 6. Твердофазный 13C-ЯМР спектр поперечно связанной ГК
Заключение
Эта новая технология двойного кросслинкинга позволяет производить различные производные ГК с различными степенями кросслинкинга. Технология, как также показывали, была подходящей для кросслинкинга ГК с другими полимерами. Используя этот новый процесс, мы показали, происходит ли кросслинкинг у молекул гиалуронана между собой или с другими полимерами ГК производными, у которых есть высокая степень кросслинкинга и значительно улучшенная биостабильность. Таким образом, диапазон водных нерастворимых пленок и гелей может быть произведен с заданными свойствами, в применении которых есть потребность. В настоящее время проводится тестирование биологической совместимости различных биоматериалов, произведенных, используя этот метод.