Абстракт
Гиалуронан (ГК) найден во внеклеточном матриксе многих тканей, где он, как думают, способствует перемещению клеток и их пролиферации. На основе недавних данных предполагают, что гиалуронан-зависимое периклеточное формирование матрикса - быстрый процесс, который происходит, поскольку клетки отделяются во время митоза и перемещения. Рост количества свидетельств внутриклеточного гиалуронана в тканях in vivo, вместе со свидетельством внутриклеточных гиалуронан-связывающих молекул, побудил нас исследовать распределение и поток ГК, гиалуронан-связывающие участки в пределах клеток и их отношение к пролиферации клеток in vitro, используя биотинилированный гиалуронан-связывающий белок и флуоресцин-маркированный гиалуронан. В проницаемых гладкомышечных клетках и фибробластах, окрашивание ГК было замечено в цитоплазме в разбросанном, сетеподобном образце и в пределах пузырьков. Ядерное окрашивание ГК наблюдалось и подтверждено конфокальной микроскопией, и часто связывалось с ядрышками и ядерными расселинами. После стимуляции сывороткой 3T3 клеток, было замечено существенное увеличение цитоплазматического окрашивания ГК, особенно во время последней профазы/ранней прометафазы митоза. Напротив, нестимулируемые клетки были отрицательны к окрашиванию. Наблюдалось явное изменение в количестве и распределении гиалуронан-связывающих участков, главным образом от исключительно ядерного распределения в нестимулируемых клетках к распределению окрашивания ГК повсюду по цитоплазме и ядру после стимуляции. Внешний флуоресцеин-маркированный ГК был распространен наиболее очевидно в пузырьках в растущих клетках, но, казалось, был ограничен отчетливо по сравнению с эндогенным гиалуронаном. Обработка интернализованного флуоресцеин-ГК была более быстрой, и цитоплазматическое распределение маркированного гиалуронана было более постоянным в клетках, повторно пересаженных в присутствии PDGF (тромбоцитарный фактор роста) или сыворотки. Эти данные предполагают, что синтез и деградация ГК могут быть близко соединены и что внутриклеточный ГК и/или его интернализация и деградация могут быть важными для пролиферации клетки.
Ключевые слова
Гиалуронан, деградация, пролиферация клетки, митоз, PDGF
Введение
Роль гиалуронана (ГК) в пролиферации клеток хорошо засвидетельствована, но механизмы, которыми он затрагивает поведение клетки, только начинают оцениваться. Одна предложенная роль для ГК - то, что он может облегчить отделение клеток во время митоза и клеточного передвижения. В пользу этого свидетельства говорит то, что ГК присутствует в цитоплазме и ядрах во многих тканях in vivo. Многие внутриклеточные ГК-связывающие молекулы, которые могут быть важными в регулировании клеточного цикла или в транскрипции генов, были также недавно описаны. Мы недавно выяснили, что ГК присутствует в ядре и цитоплазме гладких мышечных клеток и фибробластов, и что внутриклеточный гиалуронан может играть важную роль во время пролиферации клетки. В этой работе далее исследуется присутствие и обработка внутриклеточной ГК, чтобы начать понимать возможную роль внутриклеточного гиалуронана в пролиферации клеток.
Материалы и методы
Различные типы клеток были любезно предоставлены коллегами в Отделе Патологии, Университете Вашингтона. Человеческие SMC были предоставлены д-ром Russell Ross; Человеческие фибробласты кожи были предоставлены д-ром Peter Byers; 3T3 D1 клетки были предоставлены д-ром Daniel Bowen Pope; грудные эпителиальные клетки и грудные опухолевые клетки были предоставлены д-ром Karen Swisshelm. Окрашивание для внутриклеточной ГК было сделано, как описано ранее, используя биотинилированную гиалуронан-связывающую область из протеогликанов хряща, любезно предоставленную д-ром Charles Underbill, отдел онкологии, Университет Джорджтауна. Где необходимо внеклеточный ГК был удален до фиксации инкубацией клеток с 2 ед/мл Streptomyces гиалуронидазы при 37°C в течение 1 часа. Клетки были фиксированы в формалине в 2.5 % ПБС в течение 10 минут, при 22°C, а затем помещены в раствор с 0.5 % тритоном X-100 на 10 минут. Исследование проводилось при концентрации 2.5 мкг/мл в растворе ПБС, содержащем 1%-ый БСА, в течение часа при 22°C. Образец был ограничен с Техас Красным-стрептавидином. Средства контроля специфики внутриклеточного окрашивания включали обработку клеток с Streptomyces гиалуронидазой после увеличения проницаемости мембраны и прединкубацию пробы с избытком ГК.
Флуоресцеин-маркированный ГК (фГК) был приготовлен, как описано выше. Поглощение и деградация фГК были оценены в 3T3 клетках, используя их быстрый живой отклик в ответ на лишение сыворотки и легкость, с которой они могут быть синхронизированы. Для исследований поглощения клетки, культивируемые на подложках, были сделаны неподвижными в 0.5 % сыворотке в течение 48 часов, а затем их стимулировали с 10%-ым FBS или PDGF в концентрации 10 нг/мл в присутствии фГК (5 мкг/мл) и позволили поглощать маркированный ГК в течение 24 часов. Клетки впоследствии были фиксированы и затем окрашены эндогенной внутриклеточной ГК, как описано выше.
Чтобы исследовать норму деградации поглощенного фГК, клеткам 3T3 позволили поглощать фГК (добавленный в концентрации 5 мкг/мл) в течение 72 часов при нормальных условиях роста (10%-ый FBS). Затем повторно пересадили на подложке в DMEM, содержащем или 0.5 % FBS, или 0.5 % FBS плюс PDGF в концентрации 10 нг/мл, или 10%-ый FBS. Клетки были неоднократно фиксированы и исследованы флуоресцентной микроскопией на содержание фГК. Мы выяснили, что было необходимо предварительно нагрузить клетки фГК, а затем пересадить их, потому что в пробных экспериментах, в которых мы попытались смыть свободную непоглощенную фГК, внутриклеточный сигнал продолжал увеличиваться после промывки. Это происходило наиболее вероятно из-за длительного эндоцитоза фГК, который был связан с подложкой для культивации или с внеклеточным матриксом и не был эффективно смыт.
Локализация внутриклеточных сайтов закрепления ГК была сделана как описано. Средства контроля за спецификой закрепления фГК к очуствленным клеткам включали, блокируя избыток немаркированной ГК, разрушение фГК гиалуронидазой, разрушение фГК проназой (чтобы устранить возможность, что флуоресцеинированные загрязнители белка могли связывать), и инкубацию клеток со свободным, недвойным флуоресцеинамином. Средства контроля указали, что внутриклеточное закрепление было специфичным (не показано).
Визуализация и морфометрический анализ ГК-версикан матрикса были сделаны на контроле или PDGF-обработанных SMC как описано ранее. Временное отклонение фотомикроскопии использовалось в соединении с испытанием исключения частиц, чтобы исследовать кинетику формирования периклеточной муфты.
Результаты и обсуждение
Внутриклеточный гиалуронан
Гиалуронан был локализован в очувствленных клетках, используя очень специфические биотинилированные пробы, приготовленные из протеогликана хряща, аггрекана. В неочувствленных клетках, ГК была замечена во внеклеточном матриксе и на поверхности клетки как запутанная пушистая сеть (данные не показаны). Обработка гиалуронидазой Streptomyces приводит к отсутствию окрашивания поверхности клетки и периклеточного окрашивания матрикса, оставляя только остаточное точечное окрашивание поверхности клетки. В клетках, обработанных гиалуронидазой, а затем очувствленных, ГК была замечена в пределах пузырьков, а также в разбросанном, сетеподобном распределении повсюду в клетке, распределении, совместимом с каналами эндоплазматического ретикулюма (см. рисунок 1B, нижний). ГК была также замечена в пределах ядра и часто заметно связывалась с ядрышками в человеческом SMC и с ядерными расселинами в человеческих фибробластах кожи (данные не показаны). Это было подтверждено колоколизацией ГК с ядерным окрашиванием, используя конфокальную микроскопию. Когда клетки были обработаны гиалуронидазой вида Streptomyces после очувствления, все внутриклеточное окрашивание исчезло (данные не показаны).
Множество других типов клеток, таких, как бычьи эндотелиальные клетки, мышиные 3T3 клетки, нормальные грудные эпителиальные клетки и грудные опухолевые клетки, также содержало много внутриклеточной ГК (данные не показаны). В эндотелиальных клетках внутриклеточная ГК была более заметна, чем внеклеточная при этих условиях. Распределение ГК в пределах этих клеток было обычно очень похоже на описанное выше. При этом в одной из линий клеток опухоли, по мере приближения к ЭПС было больше точечных появлений внутриклеточного ГК окрашивания.
ГК была ограничена ультраструктурно в пределах ядра в других клетках, особенно в ядрышках и областях гетерохроматина вокруг ядерной периферии, совместимой с нашими наблюдениями. ГК также была найдена в полостях жесткого эндоплазматического ретикулюма. Распределение в цитоплазме, наблюдаемое в данном исследовании, совместимо с распределением в жестком эндоплазматическом ретикулюме. ГК также ясно присутствовала в пределах пузырьков. Эти наиболее вероятные эндосомы, как и флуоресцеин-маркированная ГК, интернализованы в похожих пузырьках (см. ниже). Это поднимает вопрос источника внутриклеточной ГК, а также вопрос о том, могут ли эндосомальные пузырьки, содержащие ГК, транспортировать его назад в ЭПС через ретроградный транспортный механизм.
,b>Внутриклеточная и внеклеточная ГК увеличиваются в пролиферирующих клетках
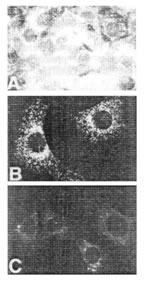
3T3 ячейки были сделаны неподвижными инкубацией в 0.5 % сыворотке в течение 48 часов и затем простимулированы, чтобы пролиферировать добавлением 10% сыворотки. В контроле, нестимулированных клетках, только небольшое количество внутриклеточного ГК окрашивания было обнаружимо (См. рисунок 1A), тогда как в стимулируемых клетках была обнаружена внутриклеточная ГК в изобилии (рисунок 1B). Самое яркое внутриклеточное ГК окрашивание было замечено в митотических клетках, где ГК, казалось, заполнила всю область клетки, окружающую хромосомы во время метафазы, и затем заполняя область между отделением хромосом во время анафазы.
Иллюстрация 1. Внутриклеточное ГК окрашивание в
(A) в контрольных 3T3 клетках
(B) в клетках, стимулируемых с эмбриональной бычьей сывороткой.
Сильное окрашивание сохранилось и во время телофазы. Во время поздней телофазы небольшое количество ГК могло быть замечено в пределах тонких, мембранных "мостов", связывающих две отделившихся дочерних клетки, как будто органоид(ы), в который была расположена ГК, были вытянуты во время разделения. Во многих случаях эти ГК-положительные "мосты" между клетками оставались намного позже митоза и часто, казалось, соединяли ядрышки одной клетки с другой. Очувствленными для контроля и стимулируемые сывороткой клетки были инкубированы с фГК, чтобы локализовать внутриклеточные ГК-связанные участки. Заметное связывание фГК с ядрышками в ядре клеток контроля происходило так же, как со слабой, подобной шнурку сетью в цитоплазме (данные не показаны). В стимулируемых клетках имело место заметное увеличение количества закрепления фГК к сетчатой сети в цитоплазме, указывающее увеличение количества доступных обязательных участков. Кроме того, в отличие от клеток контроля, фГК связывалось экстенсивно всюду по ядру и ядерной периферии в стимулируемых клетках.
Известно, что синтез и секреция ГК увеличиваются во время клеточной пролиферации. Поэтому, мы использовали испытание исключения частицы, чтобы определить, была ли ГК организована в периклеточном матриксе в SMC, стимулируемом с PDGF. Только 25 % клеток контроля показали наличие периклеточного матрикса. В клетках, стимулируемых PDGF, число клеток, формирующих ГК муфту, увеличилось приблизительно до 70%. Также подобные образования были более толстыми в стимулируемых клетках. ГК муфты присутствовали вокруг практически всех митотических клеток (данные не показаны, смотри сноску). Отклонение времени показало, что формирование периклеточной муфты происходит, когда клетки отделялись от основания во время митотического округления клетки, и таким образом, казалось, облегчало выпуск и скольжение клетки через субстрат. Таким образом, и внутриклеточная, и внеклеточная ГК координировано увеличиваются во время митоза, а количество и распределение внутриклеточных ГК-связывающих участков изменяются.
Источник и функции внутриклеточной ГК еще не ясны. Когда клеткам позволили усвоить флуоресцеин-маркированную ГК (фГК), а затем провели покраску на эндогенную внутриклеточную ГК, увидели четкую картину распределения внешнего и эндогенного материала. Внешняя фГК была в значительной степени ограничена эндосомальными пузырьками и не появлялось в солокализации с эндогенной внутриклеточной ГК в сетчатой цитоплазматической сети. Это позволило бы предположить, что некоторые из внутриклеточных ГК могут быть получены из внутриклеточного источника. С другой стороны, если внутриклеточная цитоплазматическая ГК получена из интернализации и перемещения периклеточного материала, возможно, что клетки перемещают свою собственную эндогенную ГК намного более эффективно, чем маркированную ГК. Гипотеза, что ГК перемещается, может быть поддержана результатами другого исследования, которое показало что 10T1/2 клетки быстро перемещают маркированную Техас красным ГК к цитоплазме и ядру в соединении с миграцией. Однако, трудно убедиться, что флуоресцентная метка все еще связана с ГК в этих видах экспериментов.
Инкубация живущих клеток в присутствии относительно высоких концентраций Streptomyces гиалуронидазы (20 ед/мл) в течение 18 часов почти полностью разрушила внутриклеточную ГК (данные не показаны), в то время как краткосрочная инкубация клеток с гиалуронидазой не имела никакого эффекта (см. рисунок 1). Это предполагает, что, по крайней мере, часть внутриклеточной ГК была перемещена в клетку из внеклеточного матрикса, и удаление гиалуронидазой периклеточной ГК предотвратило её интернализацию. С другой стороны, также возможно, что гиалуронидаза, так или иначе, была в состоянии проникнуть в тот же самый компартмент, содержащий внутриклеточную ГК.
Инкубация клеток с разными концентрациями хлорохина или хлорида аммония, которые, как показывали, ингибируют лизосомальную деградацию ГК, или не дала никакого эффекта, или немного увеличила количество внутриклеточной ГК в ЭПС (данные не показаны). Таким образом, неудивительно, что ГК, кажется, накапливается в эндосомах и других компартментах в присутствии лизосомальных ингибиторов. Это предполагает, что лизосомальная деградация ГК не является обязательным требованием для ее возможного перемещения.
С этой точки зрения мы можем только размышлять об источнике внутриклеточной ГК. Наблюдения Кана, согласно которым ГК присутствует в жестком эндоплазматическом ретикулюме, предполагают, что гиалуронат-синтаза (ГКС), может быть активной немедленно после ее синтеза и вставки в мембрану ЭПС, после чего сразу может начать синтезировать ГК в пути на поверхность клетки. Существенная предрегуляция синтеза ГК во время пролиферации и увеличение внутриклеточной ГК во время митоза делают эту идею вероятной. Поэтому, часть ГК действительно может быть получена из внутриклеточного синтеза. Другая возможность состоит в том, что активная ГКС, интернализуется и транспортируется к другим компартментам через ретроградный механизм. Как упомянуто выше, недавно синтезированная периклеточная ГК может быть транспортирована в клетку тем же самым способом. Ни одна из этих возможностей достаточно не объясняет, как бы то ни было, как ГК входит в ядро.
Деградация ГК также увеличивается во время пролиферации
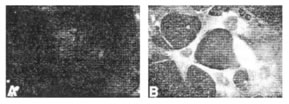
Клеткам линии 3T3 с нормальным циклом позволили усваивать фГК в течение 72 часов (рисунок 2A), а затем повторно пересеяли в присутствии бедной или богатой сыворотки или простимулировали PDGF. В бедной сыворотке клетки быстро становятся неподвижными и принимают сглаженную морфологию. В этих клетках фГК оставалась в пределах эндосомальных пузырьков и не была деградирована даже после 36 часов последующей пересадки (рисунок 2B). Напротив, клетки, которые были повторно пересажены в богатой сыворотке, быстро потеряли эндосомную фГК (рисунок 2C). Идентичные результаты были замечены, если клетки были стимулированы PDGF. Это указывает, что обработка и круговорот усвоенной ГК происходят более быстро в пролиферирующих клетках. Это предполагает, что внутриклеточная деградация ГК может играть регулирующую роль во время клеточной пролиферации, и что это близко связано с увеличением синтеза, который происходит в это время.
Иллюстрация 2. 3T3 клетки были инкубированы с фГК в течение 72 часов (А) а затем экспозированы в течение 36 часов после пересадки в присутствии (В) 0.5% бычьей сыворотки (С) 10% сыворотки.