Абстракт
Знание путей трансдукции сигнала, вовлеченных в посредничество эффектов оГК на целевых клетках может быть полезным в определении потенциальных отборных целей для ингибиторов эндотелиальных клеток (ЭК), что было бы уместной функцией в случае вмешательства в ангиогенез. Ранее мы показали, что митогенез, вызванный оГК, вызывает активацию киназы белка C и МАП киназы. Он вызывает также активацию ранних генов ответа у бычьих аортальных ЭК (БАЭК). Здесь мы демонстрируем потенциальную причастность и G-белка и тирозин-киназы в качестве связывающих элементов, предлагая существование перекрестной связи между отдельными путями трансдукции сигнала. В присутствии оГК. и PLC ?l, и PLC ?1, ?2 и ?3 были перемещены к плазматической мембране. Мы также выяснили, что G? субъединицы стали с высоким коэффициентом сродства связываться с PLC ?l, а антитела иммуно-нейтрализации, загруженные в клетки, используя липосому, добились поставки, значительно уменьшенного фосфорилирования МАП тирозин-киназы. Кроме того, фосфорилирование МАП тирозин-киназы так же, как быстрый рост клетки, было сильно уменьшено в присутствии токсина коклюша. Рас-белок был также активирован оГК в рассматриваемых клетках, при этом мощном ингибиторе этого белка Ftase 1 значительно замедлилось быстрое увеличение количества клеток.
Ключевые слова
Гиалуроновая кислота, трансдукция сигнала, эндотелиальный
Введение
Ангиогенез является существенным фактором для роста и ремонта нормальных тканей, и болезни, неблагоприятно затрагивающие ангиогенез (паралич, инфаркт миокарда, диабетическая ретинотерапия, ревматический артрит, неоплазия, СПИД), являются самой частой причиной человеческой заболеваемости и смертности в западном мире. Лучшее понимание механизмов и контроля ангиогенеза в этих ситуациях фундаментальны, чтобы снизить вероятность заболеваемости и улучшить норму лечения этих недугов. Целевая клетка для неоваскуляризации – клетка эндотелия кровеносного сосуда, и определенные ангиогенные молекулы, произведенные или индуцированные тканями, как полагают, начинают этот процесс. У одной из этих ангиогенных молекул, гиалуронана (ГК), в зависимости от его молекулярной массы, есть различающиеся роли в процессе неоваскуляризации. Высокомолекулярный полимер ГК – анти-ангиогенный, тогда как олигосахариды ГК из определенного размера (оГК), стимулируют быструю пролиферацию эндотелиальной клетки и её перемещение, два ключевых события, связанных с неоваскуляризацией, и вызывают ангиогенез in vivo. Лю и др. (1996) сообщили, что гиалуронидаза (ГКаза) опухолевых клеток вызывает ангиогенез, и что клетки опухоли используют ГКазу как одного из "молекулярных саботажников" к деполимеризации ГК, чтобы облегчить вторжение. Как следствие, продукты деструкции ГК могут далее продвинуть распространение опухоли, вызывая ангиогенез. Детальное исследование обязано характеризовать пути трансдукции сигнала, вовлеченные в посредничество эффектов оГК на целевых клетках. Как было показано недавно, оГК может активировать фосфорилирование тирозина белков, так же как Рас-белок в клетках RSV-3Y1 (Сербулеа и другие 1999). Рецептор CD44 - основной рецептор поверхности клетки для ГК спаренный с нерецептором тирозин-киназ белка, включая Lck, Fyn и Lyn в лимфоцитах T (Илангумаран и другие 1999), который был связан и с Рас-белком, и с активацией PKC в клетках T-24 (Фитцджеральд и другие 2000). Мы ранее идентифицировали некоторые из цитоплазматических связанных сигнальных промежуточных звеньев в цепи активации вызванной оГК ЭК. Здесь мы описываем активацию нескольких связанных с мембраной исполнительных элементов, которые модулируют пролиферацию в БАЭК.
Материалы и методы
БАЭК были изолированы, охарактеризованы, посеяны в культуру и собраны как описано ранее (Слевин и другие 1999). Во всех экспериментах оГК использовалась при концентрации 10 мкг/мл.
Пролиферация клеток
Клетки были загружены в триплете на 6-луночную пластину при концентрации 2*l04 и после приложения (4 часа), инкубированы на 72 часа на сывороточной бедной среде (СБС), содержащей 2%-ый FCS вместе с соответствующим ингибитором фермента, с или без оГК. Статистически существенные различия (p<0.05) были определены дисперсионным анализом, используя t-тест Стьюдента.
Липосомный посредник, загружающий антитело
Были сделаны клетки, кратковременно проницаемые, путём обработки в течение 4 минут ледяным L-? лизофосфатидилхолином (1 мкМ, 250 мкл, 4°C) в смеси глицерина (1.2M) с PBS (Пиипер и другие 1997). Антитела были применены в концентрации l-5 мкг/мл и после дальнейших 30 секунд, 2 мл предварительно подогретого SPM. Клеткам позволили восстановиться (30 минут, 37°C) перед добавлением оГК. Эффективность загрузки в клетку так же, как восстановления, была проверена исключением трипанового синего и анализом FACS (данные, не включенные).
Метод Western blotting
Полусливающиеся клетки были инкубированы в 6-луночных пластинах в течение 48 часов в SPM и после соответствующей обработки, лизаты были собраны в буфере RIPA, концентрацию белка определили при помощи использования реактива Biorad и белков (20 мкг), отделенных восстанавливающим СДС-ПААГ, используя 12%-ый гель. Белки от окрашенных гелей визуализировались, используя соответствующие моноклональные или поликлональные антитела.
Изоляция плазматических мембран и цитоплазматических фракций ячейки
Эти фракции были отделены, используя дигитониновый буфер в качестве базовой системы, как описано у Слевин и другие (1998).
Иммунопреципитация/Копреципитация
Лизаты от оГК стимулированных клеток, собранных в буфере RIPA (100 мкг), были инкубированы на ночь с соответствующим антителом, прикрепленным к A/G белку бусины агарозы. После отмывки комплексы кипятили в буфере для образцов и белки отделили друг от друга методом СДС-ПААГ, как было описано выше.
Результаты и обсуждение
Экспрессия и транслокация PLC изоформ
В БАЭК экспрессировали ?l, ?1 и ?2 изоформы PLC, но не ? или ?. Экспертиза мембранной фракции оГК активизировала клетки, показала перемещение PLC ?l, так же как PLC ?1, PLC ?2 и частично PLC ?3 (Рис. 1). Пока PLC ? изоформы, как известно, активируются тирозин-киназами рецептора, PLC ?3 изоформы связаны с соединенными рецепторами G-белка, предполагая возможное существование многократных путей трансдукции сигналов, активизированных оГК.
Изучение копреципитации
Иммунопреципитанты, полученные после инкубации клеток, обработанных оГК, с антителами к G? субъединице, содержали существенные количества иммунореакционного белка PLC ?l (Рис. 2). Подобный результат был получен, когда лизаты были имунопреципитированы с анти-G?i/o/t/z (данные не показаны). Только слабая иммунореактивность к PLC ?3 была обнаружена. Преинкубация клеток с токсином коклюша (100 нг/мл, 30 минут) уменьшал ассоциацию PLC ?l с G? (Рис. 3), предполагая, что взаимодействие между этими двумя отдельными путями может быть важным в регулировании функционирования оГК.

Иллюстрация 1. оГК вызывает мембранное перемещение изоформ PLC в БАЭК. Цитоплазматическая фракция не показала очевидных изменений в концентрации (данные не включены). Были нанесены равные концентрации белка, как показало измерение по методу Брэдфорд. Группа, соответствующая PLC, была идентифицирована, используя исследования по ингибированию пептида (данные не включены).
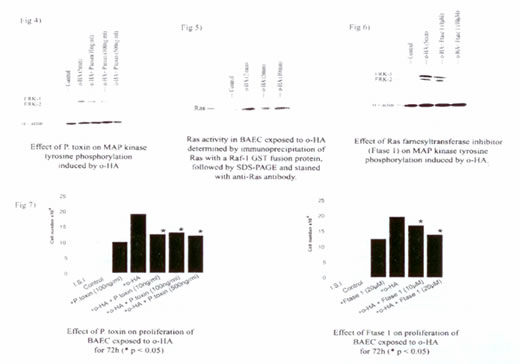
Иллюстрация 2. БАЭК, подвергнутые обработке оГК с или без токсином коклюша, был иммунопреципитирован с антителом к G? субъединице, отделены методом СДС-ПААГ и окрашены анти- PLC ?l.
Иллюстрация 3. Экспрессия фосфорилированной МАП тирозин-киназы в клетках, обработанных оГК с ингибиторными антителами к G-белку.
Эффект G-белков на фосфорилирования VFG тирозин-киназы
Фосфорилирование МАП тирозин-киназы (p42/p44) было значительно уменьшено в БАЭК, загруженных антителами, направленными к G?i/o/t/z и G? субъединице (Рис. 4), пока антитела, направленные к G?s/olf и белкам Gq, не имели никакого эффекта (данные не включены). Токсин коклюша (100 нг/мл) также был в состоянии блокировать фосфорилирование тирозин-киназы. Эти результаты предполагают роль элементов, связанных с G?-белком в посредничестве оГК индуцируемой клеточной пролиферации.
Иллюстрация 4. Эффект токсина коклюша на фосфорилирование МАП тирозин-киназы, индуцируемое оГК.
Активация Рас-белка
Рас-белок был активирован в течение 2 минут после добавления оГК в БАЭК (Рис. 5), как было измерено согласно иммунопреципитации Рас-GTP, граничащего с белком GST-Raf-1, сплавленным с киназой, который распознает только активную форму (TCS Biologicals). Ингибирование активации Рас-белка, используя Ftase 1 (10 мкМ, Рас-фарнезилтрансферазы ингибитор, Calbiochem), уменьшает оГК индуцированное фосфорилирование МАП тирозин-киназы (Рис. 6).
Иллюстрация 5. Активность Рас-белка в БАЭК, определенная иммунопреципитацией Рас-GTP, граничащего с белком GST-Raf-1, сплавленным с киназой, согласно СДС-ПААГ и окраске с анти-Рас антителом.
Иллюстрация 6. Эффекту Рас-фарнезилтрансферазного ингибитора (Ftase 1) на фосфорилирование МАП тирозин-киназы, вызываемое оГК.
Изучение пролиферации
Пролиферация клеток БАЭК значительно уменьшалась и в присутствии Ftase 1 (10 мкM) и в присутствии токсина коклюша (100 нМ, G? белковый ингибитор) как показано на Рис. 7. В качестве контроля рассматривали клетки, обработанные bFGF, которые также показывали сокращение пролиферации в присутствии Ftase 1, но не в присутствии токсина коклюша (данные не включены). Ингибитор GPantag 2A (ингибитор белка Gq, Calbiochem) не имел никакого эффекта.
Иллюстрация 7.
А) Эффект токсина коклюша на пролиферацию БАЭК, подвергнутых обработке оГК в течение 72 часов (*p <0.05)
Б) Эффект Ftase 1 на пролиферацию БАЭК, подвергнутых обработке оГК в течение 72 часов (*p <0.05)
Заключение
Пролиферация, вызываемая оГК в сосудистых эндотелиальных клетках, происходит активацией путей трансдукции сигнала, которые сходятся на МАП киназе. По крайней мере два отдельных пути кажутся важными. Тирозин-киназа связывает элементы, включая PLC ? (не показано здесь), и киназу Raf-1 вместе с G-белком, который, в свою очередь, связан с такими элементами, включая PLC ?, G?i/o/t/z и G? субъединицу, которые вовлечены и возможно показывают перекрестную связь перед стимуляцией Рас-белка и косвенно с МАП киназой. Мы находимся в процессе установления важности G?? субъединиц в процессе посредничества оГК, используя БАЭК, трансфицированные плазмидными векторами, содержащими ?-ARK1 активные последовательности (Коч и другие 1994).