Абстракт
Углеводные полимеры и олигомеры - превосходные кандидаты хранение биологической информации на молекулярном уровне через изменения в химическом составе, первичной последовательности и шаблоне ветвления. Разнообразие первичной структуры полисахарида предоставляет разнообразие в структуре более высокого порядка, и информация также может храниться в трехмерных пространственные взаимодействиях сахарных остатков. Это позволяет углеводам функционировать как строго определенным маркерам в биологических процессах узнавания.
Углеводы работают на поверхности клетки, где они часто представлены как компоненты гликопротеинов, гликолипидов или протеогликанов, заякоренных в мембране клетки. Передача сигналов и узнавание обычно вовлекаются белково-углеводные взаимодействия. Аналогично появляются и случаи сигнальных взаимодействий углевода с углеводом. Взаимодействия между углеводами также однозначно важны в стабилизации трехмерных структур многих биологически активных олиго- и полисахаридов.
Многие полисахариды, например, гиалуроновая кислота (ГК), содержат заряженные группы, которые могут затрагивать их конформацию и, таким образом, их физико-химические и биологические свойства. Взаимодействия, которым подвергаются сами эти полимеры, очень важны в стабилизации трехмерных структур, которые могут быть важными для их функции в передаче сигналов и узнавании. В этой статье мы показываем, что степень и природа ассоциации гиалуроната натрия (ГН) в водном растворе, наблюдаемые использованием AFM (метод атомно-силовой микроскопии), чувствителен к присутствию солей.
Ключевые слова
Атомно-силовая микроскопия (АСМ), гиалуроновая кислота (ГК), зондо-сканирующая микроскопия (ЗСМ), самоассоциация.
Введение
Метод зондов сканирующей микроскопии (ЗСМ) был ценным инструментом для обычного отображения сложных биологических структур так же хорошо, как и индивидуальных молекул с миллимикронным масштабом разрешения. Взаимодействия «углевод-углевод» были исследованы в нескольких полисахаридах, используя АСМ. В этой статье мы документируем увеличение степени ассоциации цепи с увеличением концентрация ГК и формирование жесткого волокна сети молекул ГК в присутствии добавленных в раствор солей низкой молекулярной массы.
Материалы & Методы
Рост бульона культуры бактерии Streptococcus equi был контролируем таким образом, чтобы происходила продукция ГК с молекулярной массой 2*106 г/моль. Эта ГК с высокой молекулярной массой была очищена, а высокая температура мешала произвести образец ГН более низкой молекулярной массы (3*105 г/моль). Эти образцы ГН поставлялись компанией Vitrolife UK Ltd.
Исходные растворы ГН были разбавлены дистиллированной водой или раствором соли низкого молекулярного веса до итоговой концентрации полимера 1 - 30 мкг/мл. Определенное количество этих разбавленных растворов было депонировано путем распыления приготовленного аэрозоля на недавно расколотую слюду (Polysciences, Inc, Уоррингтон, Пенсильвания) и высушены на воздухе. Слюда легко подготавливается раскалыванием и обеспечивает атомарно плоское основание, свободное от артефактов, найденных на других обычно используемых основаниях для ЗСМ таких, как высокоориентированный пиролитический графит. После сушки на воздухе, в течение нескольких часов, образцы были готовы к показу методом АСМ.
Экземпляры были исследованы, используя установку ThermoMicroscopes AutoProbe® CP Research (Саннивейл, Калифорния), сканирующий зондовый микроскоп, оборудованный головкой зонда NCAFM. Для всех изображений использовался пьезоэлектрический сканер с диапазоном до 50мкм. Сканер был калиброван в системе координат хy, используя одномикронную решетку, а также по шкале z, используя несколько обычных стандартов высоты. Частот колебаний ? консоль/наконечник была компенсирована от ?0 до более высоких частот несколькими кГц. Амплитуда колебаний и точка отсчета по шкале z были выбраны, чтобы избежать контакта образца с наконечником согласно необходимым процедурам для бесконтактного способа отображения. Все измерения были выполнены на воздухе при окружающем давлении и влажности. Изображения были сохранены как 256x256 точеные матрицы и проанализированы, используя программное обеспечение установки AutoProbe® для обработки изображения, поставляемое ThermoMicroscopes.
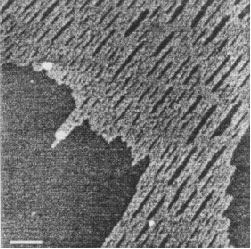
Иллюстрация 1. Единица масштаба = 200 нм.
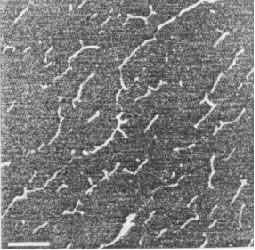
Иллюстрация 2. Единица масштаба = 500 нм.
Подобные сетевые петли были сформированы при концентрации ГН 10 мкг/мл в водном растворе в отсутствии соли, как замечено в иллюстрации 1. Для сетей ГН не было показано никаких молекулярных концов или хвостов. Значимая толщина этих молекулярных листов составляет 0.66 нм, что совместимо с монослоем молекул ГН, предполагая сильную латеральную ассоциацию. Разбавление раствора ГН до 1-3 мкг/мл приводит, главным образом, к единственному виду молекулярной цепи, как показано на иллюстрации 2. В присутствии в растворе соли низкой молекулярной массы были замечены различной степени ассоциации или скопления цепей. С 0.10 М ацетатом натрия (иллюстрация 3) или с 0.10 М. ацетатом лития (иллюстрация 4) наблюдались жесткие переплетения волокон. Средняя длина связки волокнистого полимера, измеренная на подложке из слюды, составляет приблизительно 1.4 нм, предлагается, что они составлены из ассоциации нескольких цепей. Боковой интервал между сильно упакованными волокнами составляет приблизительно 19 нм.
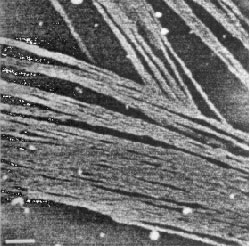
Иллюстрация 3. Единица масштаба = 200 нм.
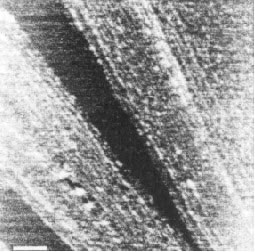
Иллюстрация 4. Единица масштаба = 250 нм.
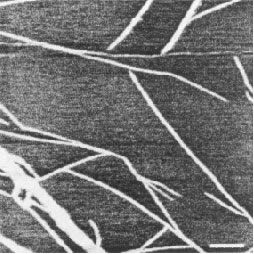
Иллюстрация 5. Единица масштаба = 250 нм. Меньшая боковая упорядоченность была замечена при более высокой концентрации ацетата натрия, порядка 1.5 М, как показано на иллюстрации 5. Средняя длина прутообразной связки полимера, измеренной на подложке из слюды, имела размер больше чем 1.7 нм.
Уведомления
Авторы уведомляют о финансовой поддержке от грантов Национального Института Здоровья. Образцы ГК были любезно предоставлены компанией Vitrolife UK Ltd.