Абстракт
Мы ранее показали, что внутрисуставная терапия с применением препаратов гиалуронана (849 кДа), ГК84 – регулирует экспрессию белка теплового шока 72 (Hsp72) и подавляет дегенерацию синовиальных клеток при модели артрита. В том исследовании ГК был деградирован до ГК олигосахаридов в синовиальной ткани, предполагая, что ГК84 или продукты деградации ГК могут регулировать экспрессию Hsp72. Таким образом, в данной работе, мы исследовали эффекты олигосахаридов ГК различной молекулярной массы на экспрессию Hsp72 и/или клеточную смерть в пораженных клетках. Вестерн блоттинг анализ показал, что обработка клеток K562 тетрасахаридами ГК регулирует экспрессию Hsp72 после гипертермии. С другой стороны, обработка клеток производными ГК других размеров (ди-, гекса-, дека-, додека- сахариды), ГК84 или тетрасахаридами кератансульфата не выявляла изменений в экспрессии белка Hsp72. Обработка клеток тетрасахаридами ГК регулирует не только экспрессию белка Hsp72, но также и Hsp72 мРНК экспрессию, а также усиливает активацию HSF1, фактора транскрипции, управляющего экспрессией Hsp72, после подвергания гипертермии. Так как уровень экспрессии белка Hsp72 не был затронут при добавлении тетрасахаридов ГК, когда клетки K562 были сохранены при 37°C без всякого напряжения, очевидно, что тетрасахариды ГК не действуют как фактор стресса. Кроме того, тетрасахариды ГК подавляют клеточную смерть в случае, когда клетки K562 уязвимы к гипертермии и PC12 клетки лишены сыворотки. Эти результаты предполагают, что определенные типы олигосахаридов, то есть, тетрасахариды ГК – регулируют экспрессию Hsp72, увеличивая активацию HSF1 в условиях стресса.
Ключевые слова
Смерть клетки, фактор теплового шока 1, фактор теплового шока 72. олигосахариды гиалуронана.
Введение
Белки теплового шока (Hsp) призваны устранить повреждение клеток, когда они подвергаются неблагоприятному экологическому воздействию. Белок Hsp70 подавляет апоптоз, предотвращая выработку каспазы3. Мы ранее показали, что внутрисуставная терапия с применением препарата ГК (840 кДа), ГК84 подавляет вырождение синовиальных клеток на примере собачьей модели артрита и регулирует экспрессию белка-фактора Hsp72. В том эксперименте мы также исследовали кинетику деградации ГК84 в синовиальных тканях, вводя флуоресцентно маркированный ГК84, и выяснили, что некоторые маркированные ГК частицы, не могут быть обнаружены посредством ГК-связывающего белка, который связывается специфично с молекулами ГК, большими по размеру, чем декасахариды. Эти наблюдения позволили сделать предположение, что олигосахариды ГК, сформированные через деградацию ГК84 в ткани, могут подавить повреждение клетки путем регуляции экспрессии Hsp72.
В данном исследовании мы приготовили олигосахариды ГК различных молекулярных размеров и рассматривали клеточные культуры с ними в условиях стресса, чтобы выяснить, подходящий размер олигосахаридов ГК, который будет регулировать экспрессию Hsp72 или подавлять клеточную смерть. Эффекты ГК молекул на экспрессию Hsp72 были выявлены, исследуя уровни экспрессии белка Hsp72 и Hsp72 мРНК, активацию фактора теплового шока 1 (HSF1), фактора транскрипции, управляющего экспрессией Hsp72 в клетках K562, подвергнутых гипертермическому стрессу. Белок HSF1, как известно, передается ядру из цитоплазмы и связывается с элементом теплового шока в ДНК. Кроме того, HSF1 фосфорилируется, и его молекулярная масса, таким образом, увеличивается, когда происходит активация, что происходит вскоре после теплового стресса. В дополнение к экспрессии Hsp72 и активации HSF1, были исследованы эффекты молекул ГК на механизмы клеточной смерти, используя клетки K562, подвергнутые гипертермии и клетки PC12 в условиях лишения сыворотки.
Было сообщено, что фрагменты ГК вызывают ангиогенез и/или индуцируют экспрессию генов, вовлеченных в воспалительный ответ. Мы показываем здесь новую активность олигосахаридов ГК, то есть регуляцию экспрессии Hsp72 через усиление активации HSF1 в условиях стресса.
Материалы & методы
Приготовление олигосахаридов
Олигосахариды ГК были приготовлены из продуктов деградации, произведенных обработкой ГК ( Корпорация Seikagaku, Токио, Япония ) диметисульфоксидом, содержащим HCl или выделенной из тестикул гиалуронидазой ( Корпорация Seikagaku, Токио, Япония ). Деградированная ГК была разделена на фракции, содержащие ГК олигосахариды разного размера путём анионообменной хроматографии согласно измененному методу Инуэ и другие. Ненасыщенные олигосахариды ГК были приготовлены из продуктов деградации, произведенных обработкой ГК хондроитин AC-1 лиазой (Корпорация Seikagaku), тем же самым хроматографическим методом, как упомянуто выше. В данном исследовании использовались следующие ГК олигосахариды: ГК2, ненасыщенные дисахариды ГК (?ГК2), ГК4, ?ГК4, ГК6, ?ГК6, ГК8, ГК10, ГК12.
Кератан-сульфат олигосахариды, Gal(SO3)-GlcNAc (SO3) [L4] и Gal(SO3)-GlcNAc (SO3)-Gal(SO3)-GlcNAc(SO3) [L4L4], были приготовлены, используя кератаназу II (Корпорация Seikagaku), обработкой кератан-сульфата (ребро акулы, Корпорация Seikagaku, Япония) через последовательные шаги фильтрации геля и анионообменной адсорбционной хроматографии на колонке. Эти L4 и L4L4 использовались для сравнения с ГК олигосахаридами как другой вид глюкозаминогликанов олигосахаридов.
Размеры ГК олигосахаридов были определены HPLC.
Культура клеток K562 для обнаружения Hsp72 и HSF1
Был проведен анализ вестерн блоттинга, исследуя клетки K562, которые были инкубированы в присутствии 0, 1, 10 или 100 нг/мл ГК2, ?ГК4, ГК6, ГК10, ГК12, ГК84 или L4L4 при 43°C в течение 20 минут, сопровождаемый дальнейшей инкубацией при 37°C в течение 2 часов. Клетки K562, инкубированные при 37°C в течение 2 часов и 20 минут без всякой обработки, использовались как 'без шоковой температуры' нормальный контроль. Кроме того, клетки K562, инкубированные в присутствии ?ГК4 при 37°C в течение 2 часов и 20 минут, были проанализированы методом вестерн блоттинга, чтобы исследовать, вызвана ли экспрессия Hsp72 ?ГК4 в условиях стресса.
Чтобы обнаружить экспрессию Hsp72 мРНК методом вестерн блоттинга, клетки K562 были инкубированы в присутствии или отсутствии ?ГК4 в концентрации 1 нг/мл при 43°C в течение 20 минут, с или без дальнейшей инкубации при 37°C в течение 30 минут, 1 или 2 часов.
Чтобы оценить активацию HSF1, используя вестерн блоттинг, клетки K562 были инкубированы с 0, 1, 10 или 100 нг/мл ?ГК4, ГК4, ГК6, ГК8 или ГК84. Клетки K562 были оставлены при 42°C или 43°C в течение 20 минут. Клетки K562, инкубированные при 37°C в течение 20 минут без всякой обработки, использовались как 'без шоковой температуры' нормальный контроль.
Антитела, используемые в иммуноокрашивании Hsp72 и HSF1
Для обнаружения Hsp72, моноклональное анти-Hsp72 антитело ( RNP1197, Amersham, Бакингемшир, Англия ) использовалось как первое антитело и пероксидаза хрена или FITC-сопряженный козий антимышиный IgG (Лаборатория& Jackson., Вест Гроув, Пенсильвания) использовались как второе антитело.
Для обнаружения HSF1, кроличье анти-HSFl поликлональное антитело (SPA-901, Stressgene, Виктория, до н.э., Канада) использовалось как первое антитело и пероксидаза хрена или FITC-сопряженный козий антикроличий IgG (Лаборатория& Jackson., Вест Гроув, Пенсильвания) использовались как второе антитело.
Вестерн блоттинг анализ Hsp72
Полная РНК была выделена из клеток контроля K562 и каждой культуры ?ГК4-обработанных клеток. Каждый образец фракционировался электрофоретически на 1 %-ом агарозно-формальдегидном геле и затем был перенесен на нейлоновую мембрану. Для гибридизации мембрана была инкубирована на ночь при 42°C в присутствии денатурированного 32P-маркированного человеческого hsp72 олигонуклеотидного образца (Oncogene Science, Inc, Кембридж, Массачусетс, США), добавленного к раствору для предскрещивания. Маркированное исследование кДНК, определенное для глицеральдегид-3-фосфат дегидрогеназы (GAPDH), использовалось как контроль над гибридизацией. Мембрана была промыта >RT в SSPE, затем подвергнута авторадиографии.
Конфокальная лазерная сканирующая микроскопия
Клетки K562 были фиксированы параформальдегидом, затем изменили клеточную проницаемость инкубацией в ПБС, содержащем Tween 80. Клетки были инкубированы с кроличьими анти-HSFl поликлональными антителами, сопровождаемыми FITC-сопряженным козьим антикроличьим IgG. Затем они наблюдались, используя конфокальный лазерный сканирующий микроскоп (Leica, Гейдельберг, Германия).
Детекция клеточной смерти
Чтобы оценить эффект ?ГК4 на клеточную смерть, вызванную гипертермией, клетки K562 были инкубированы с ?ГК4 на 1 нг/мл в течение 20 минут при 43°C, сопровождаясь инкубацией в течение 2 или 4 часов при 37°C. Клетки K562, инкубированные в теченик 4 часов при 37°C без всякой обработки, использовались как 'без шоковой температуры' нормальный контроль. Затем эти клетки были инкубированы с Аннексином V (R&D Systems Europe Ltd., Великобритания), который связывается с фосфотидилсерином, представленным на внешней поверхности мембраны мертвых клеток, только после обработки клеточной культуры как описано выше. Смерть клеток была проанализирована методом проточной цитометрии (FACScan; Becton-Dickinson, Фрэнклин Лэйк, Нью-Джерси, США).
Было сообщено, что лишение сыворотки вызывает апоптоз в клетках PC12. Клетки PC12 были культивированы в условиях лишения сыворотки в присутствии олигосахаридов ГК, ГК84 или KS олигосахаридов в концентрации 100 нг/мл. Оценка клеточной смерти была выполнена методом исключения трипанового синего, 24 часа после начала культивации. Норма выживаемости клеток, культивируемых в отсутствии сыворотки, но в присутствии 100 нг/мл фактора роста нерва (NGF), была взята за 100 %.
Результаты
Эффекты олигосахаридов ГК на экспрессию Hsp72
Экспрессия белка Hsp72 была обнаружена даже в необработанных клетках K562, не подвергнутых гипертермии. Результаты показали, что обработка клеток K562 с ?ГК4регулирует экспрессию Hsp72 через 2 часа после подвергания гипертермии (рисунок la). Тот же самый результат был получен в случае ГК4-рассматриваемых клеток (данные не показаны). Экспрессия Hsp72 не была затронута обработкой ?ГК4 в случае клеток, не подвергнутых гипертермии (рисунок 1b). Уровень экспрессии белка Hsp72 не был изменен обработкой ГК2, ГК6, ГК84, L4L4 (рис. la), ГК12, ( данные не показаны ) или ГК10 (данные не показаны) в случае K562 клеток, подвергнутых гипертермии.
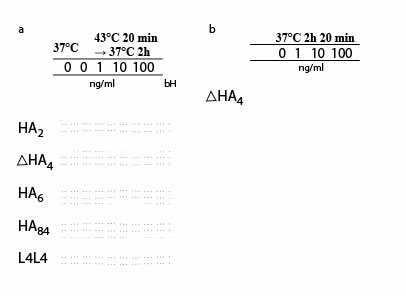
Иллюстрация 1.
(a)Вестерн блоттинг Hsp72 в клетках K562, подвергнутых гипертермии в присутствии или отсутствии ГК2, ?ГК4, ГК6, ГК10, ГК84 или L4L4.
(b) Вестерн блоттингHsp72 в клетках K562, инкубированных при 37°C в присутствии или отсутствии ?ГК4.
bH: бактериальный Hsp72, используемый как контроль.
Анализ вестерн блоттинг показал, что экспрессия Hsp72 мРНК в клетках K562 был отрегулирован через 30 минут и 1 час после подвергания гипертермии в результате обработки с ?ГК4 (рисунок 2).
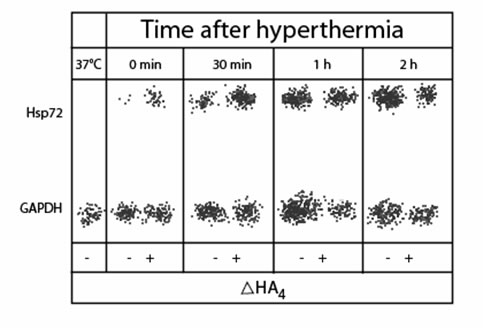
Иллюстрация 2. Вестерн блоттинг Hsp72 в клетках K562, инкубированных в присутствии (+) или отсутствие (-)?ГК4 на 1 нг/мл.
Эффекты олигосахаридов ГК на активацию HSF1
Анализ вестерн блоттинг показал, что обработка клеток K562 с ГК4 или ?ГК4, повысила уровень регуляции фосфорилированного HSF1 (приблизительно 80 кДа), активированная форма HSF1 и уменьшила уровень нефосфорилированного HSF1 (приблизительно 70 кДа), в зависимости от дозы в клетках, подвергнутых гипертермии при 42°C (рисунок 3a). Кроме того, ГК4 или ?ГК4 увеличили уровни и фосфорилированного, и нефосфорилированного HSF1, когда ячейки были подвергнуты гипертермии при 43°C (рисунок 3b). На активацию HSF1 немного оказывали влияние ГК8, ГК84 (рисунок 3b) или ГК6 (данные не показаны).
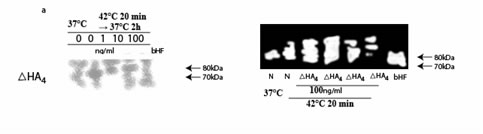
Иллюстрация 3.Вестерн блоттинг HSF1 в клетках K562, обработанными ?ГК4, ГК4, ГК8 или >ГК84 немедленно после подвергания их гипертермии при 42°C (a), или 43°C (b) в течение 20 минут.
bHF: бактериальный HSFl, используемый как контроль.
Иммунодепозиты HSFl были обнаружены в ?ГК4-обработанных (рисунок 4b) так же как и в необработанных (рис. 4a) клетках K562, не подвергнутых гипертермии. После подвергания гипертермии, иммунодепозиты HSFl были обнаружены как гранулированные структуры в клетках K562, инкубированных в отсутствие ?ГК4, (рисунок 4c, e). Гранулы HSFl-положительные в клетках, инкубированных при 37°C еще на 2 часа, были немного большими в размере, чем наблюдаемые после подвергания гипертермии (рисунок 4c, e). Гранулы HSFl-положительные в клетках K562, инкубированных в присутствии ?ГК4 (рис. 4d, f) были лучше, чем те в ячейках, выведенных в отсутствии ?ГК4 (рис. 4c, e) после подвергания гипертермии.
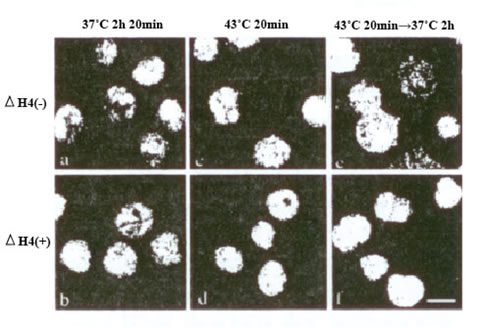
Иллюстрация 4. Иммуноокрашивание HSFl в клетках K562, инкубированных в присутствии (?ГК4(+); b, d, f) или отсутствие (?ГК4(-); a, c, e) ?ГК4на 1 нг/мл. Клетки K562 были инкубированы при 37°C в течение 2 часов и 20 минут (a, b), при 43 °C в течение 20 минут (c, d), или при 43 °C в течение 20 минут, сопровождаемых инкубацией при 37°C в течение 2 часов (e, f).
Бар = 10 мкм.
Эффекты олигосахаридов ГК на клеточную смерть Обработка ?ГК4 ингибирует смерть клетки в случае клеток K562, как определено 2 и 4 часов после подвергания гипертермии (рисунок 5).
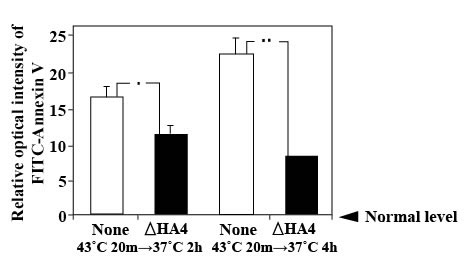
Иллюстрация 5. Анализ методом проточной цитометрии клеточной смерти в случае клеток K562, инкубированных в присутствии или отсутствии ?ГК4 в концентрации 1 нг/мл.
**: P <0.01; *: P <0.05 (тест Стьюдента). Апптоз PC12 клеток в условиях лишения сыворотки был предотвращен обработкой клеток тетрасахаридами ГК (рисунок 6). Среди олигосахаридов, проверенных в данном исследовании, ГК4 и ?ГК4 показали высокую эффективность. С другой стороны, обработка с другим олигосахаридом ГК высокой молекулярной массы ГК (ГК84) или кератан-сульфат олигосахариды слабо подавляла клеточную смерть (рисунок 6).
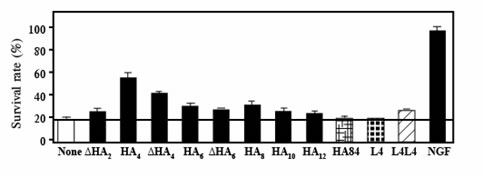
Иллюстрация 6. Нормы выживания клеток PC12 в условиях лишения сыворотки в присутствии или отсутствии нескольких видов сахаридов (100 нг/мл).
NGF: фактор роста нервов
Обсуждение
Критический размер олигосахаридов ГК был необходимым для регуляции экспрессии Hsp72, включая активацию HSF1 в клетках K562, подвергнутых стрессу гипертермии, и чтобы подавить клеточную смерть в случае PC12 клеток в условиях лишения сыворотки в данном исследовании. ГК6 использовались как инструмент для того, чтобы исследовать поверхность клетки в исследовании функций ГК рецептора, имея необходимый минимальный размер, чтобы эффективно конкурировать с ГК производными в закреплении на поверхности его клеточного рецептора. ГК4 так же хорошо, как ?ГК4 повышал регуляцию экспрессии Hsp72 в данном исследовании, предполагая возможность наличия пока еще неопознанных рецепторов для тетрасахаридов ГК в клетках.
Обработка ?ГК4 подавляет формирование гранул HSF1 в клетках, подвергнутых гипертермии. Сарж и др. показал, что кинетика появления гранул HSF1 в ядрах клеток Hela во время теплового шока очень хорошо коррелирована с кинетикой связывания ДНК HSF и транскрипцией гена теплового шока. Альтернативно они отметили возможность, что наблюдаемые гранулы могут представлять собой большие соединенные частицы бездействующего HSF1. Это хорошо совпадает с нашими нынешними результатами, что обработка ?ГК4 подавляет формирование гранул HSF1 и регулирует активацию HSF1 так же, как экспрессия Hsp72 после подвергания гипертермии.
В заключение наши результаты показывают, что тетрасахариды ГК регулируют экспрессию Hsp72 увеличением уровня активированного HSF1 в условиях стресса, но не в нормальных условиях. Когда ГК нативно деполимеризован гиалуронидазами или свободными радикалами in vivo, ГК может приобрести новую функцию, то есть повышение регуляции экспрессии Hsp72.