Были изучены эффекты влияния мочевины, поваренной соли (NaCl), гидрохлорида гуанидина (GuHCl) и сахарозы на вязкоупругие свойства растворов гиалуроната натрия (ГН). Мочевина не изменяла и хранение, и потери модулей так значимо, NaCl и GuHCl уменьшали оба модуля, в то время как сахароза увеличивала оба модуля. Критическая концентрация наложения C* была определена как точка сгибания на графике сдвига нуля характерной вязкости против концентрации для растворов ГН с и без мочевины, NaCl, GuHCl или сахарозы. Это позволило предположить, что ионы натрия или гуанидина экранируют электростатическое отталкивание молекул ГН, следовательно, уменьшить измерение катушки и C* перемещен в область более высоких концентраций. Однако, сахароза увеличивает хаотичное сцепление между молекулами ГК и продвигает создание водородных связей, а затем C* для растворов ГН с сахарозой перемещается в область более низких концентраций. И C*, и величина сдвига нуля характерной вязкости не зависят так сильно от концентрации добавленной мочевины или в присутствии или отсутствии 0.2 M NaCl. Это согласуется с экспериментальными результатами, полученными из светорассеивания. Радиус циркуляции Rg и гидродинамический радиус Rh были определены как функции концентрации мочевины и сахарозы в присутствии 0.2 M NaCl светорассеиванием. Хотя добавление сахарозы уменьшает измерения катушки ГН и укрепляет молекулы ГН в разведенных растворах, это увеличения и хранение, и потери модулей сконцентрированных растворов ГН из-за повышения формирования временной сети через недавно созданные водородные связи. Оба модуля ГК растворов с мочевиной были выше, чем те же без мочевины в более низкой области угловой частоты и имеют тенденцию становиться почти теми же самыми в более высокой области угловой частоты. Переход угловых частот обоих модулей только немного уменьшается с добавлением мочевины. Было обнаружено, что разрушение водородных связей из-за мочевины, даже если это происходит, не затрагивает значительно реологическое поведение растворов ГК. Межмолекулярные водородные связи, которые приведят к формированию сети во многих гелеобразующих полисахаридах, кажется, не существуют в растворах ГК.
Мочевина, гуанидин гидрохлорид, водородные связи, реология, светорассеивание
Гиалуроновая кислота (ГК) - главный макромолекулярный компонент межклеточной матрицы большинства соединительных тканей, таких как синовиальная жидкость, хрящ, стекловидное тело глаза. Из-за его уникальных вязкоупругих свойств это используется как лечение артрита и хирургическая помощь в глазной хирургии. ГК - линейный полисахарид, состоящий из последовательности повторяющихся дисахаридов. Эти два сахаридных остатка являются D-глюкуроновой кислотой и N-ацетил-D-глюкозамином, которые связаны ?(1-3) и ?(1-4) друг с другом.
Реологические особенности растворов ГК были широко изучены, особенно взаимосвязь между его смазочными и шоко-абсорбирующими функциональными возможностями в синовиальной жидкости и ее вязкоупругостью. Свойства текучести нормальной синовиальной жидкости, выделенной из человека и суставов крупного рогатого скота были сильно изучены и показано утончение при высоких пропорциях сдвига. В сравнении динамической вязкости и статической вязкости синовиальной жидкости в бесконечных временных рамках, Маерс и другие выяснили, что вязкость в нулевой частоте и нулевом сдвиге согласуются друг с другом, и синовиальная жидкость действует только как вязкая среда в человеческих суставах под очень замедленным движением. Сообщается, что в суставах остеоартрита, вязкоупругость синовиальной жидкости уменьшается, и появляется ГК низкого молекулярного веса. Это важно для того, чтобы изучить эффект добавления ГК низкой молекулярной массы к ратсорам ГК высокой молекулярной массы. Моррис и другие выяснили, что добавление сегментированных цепей ГК, сформированных ферментативной деградацией, существенно уменьшает хранение и потери модулей, пока Фуджи не заметил, что похожий феномен существует при использовании сегментированных цепей, подготовленных физическими методами такими, как сверхзвуковая деградация или пиролизис. В предыдущем эксперименте предположили, что выживающий фермент продолжает деградацию длинных молекулярные цепи ГК.
Несколько авторов сообщили, что молекулярная катушка ГК расширяется при низкой ионной силе, и высоком pH факторе, вызывающем увеличение внутренней вязкости. Однако, Престон и другие оказались неспособны проверить расширение молекулы ГК с уменьшением ионной силы экспериментами по светорассеянию. Клиленд сообщил, что внутренняя вязкость и радиус циркуляции ГК составляли 1400 мл/г, 453 мл/г и 75.8 нм, 62.5 нм в 0.01 M и 2.0 M растворах NaCl соответственно. Моррис и другие показали, что увеличение ионной силы в растворах ГК, аналогично понижению pH. Уменьшение вязкости следует из подавления электростатических отталкиваний между отдельными группами карбоксила. Скотт предположил, что карбоксильная группа в ГК формирует водородную связь с одной из гидроксильных групп в остатке уроновой кислоты; и это было подтверждено. Это понятие "супер-водородная связь" может быть использовано, чтобы объяснить расширенные измерения катушки при физиологическом значении pH и ионной силы.
В данной работе влияние мочевины на вязкоупругие свойства растворов ГК было исследовано, чтобы понять роль водородных связей потому, что мочевина, как известно, является разрывателем водородных связей. Затем, влияние мочевины на реологические свойства растворов ГК были сравнены с таковым для гуанидин гидрохлорида, который также является известный разрывателем водородных связей, а также электролит как хлорид натрия.
Приготовление образцов растворов
Три образца порошкообразных ГК, выделенных из среды культуры Streptococcus equi и очищенных, были любезно предоставлены Denki Kagaku Kogyo Co., Ltd. и HoyaCo., Ltd.. Молекулярные массы тех образцов определены из внутренней вязкости, используя параметры Марка-Хувинка - 1.6*106 и 2.02*106 и 4.83*105, соответственно. NaCl, GuHCl, и мочевина биохимической чистоты были куплены у Wako Pure Chemical Industries, Ltd. (Осака, Япония) и ICN Biomedicals, Inc (Огайо, США) соответственно и использовались без дальнейшей очистки. Растворы ГК различных концентраций были приготовлены взвешиванием и растворением в NaCl, GuHCl, и/или мочевине и размешивались в течение одного дня при комнатной температуре. Было уделено особое внимание к возможному загрязнению бактериями.
Измерения светорассеивания
Измерения светорассеивания были выполнены, используя самодельный спектрометр для ГН растворов в присутствии мочевины в растворе 0.2 M NaCl. Среднее значение молекулярного веса для измерений светорассеивания - 4.83*105. Перед измерениями типовые растворы были полностью отдиализованы против соответствующих растворов мочевины и 0.2 M NaCl. Источником света был аргоновый ионный лазер, которым управляют при 488.0 нм. Температурараствора образца была отрегулирована в пределах ±0.01 °C. Корреляционные функции интенсивности светорассеивания была получена с помощью ALV-5000/E, многократного цифрового коррелятора. Радиусы циркуляции были определены обычной угловой зависимостью интенсивности рассеивания. Гидродинамические радиусы ГК были определены из среднего числа шкалы распада, полученного при использовании третьего кумулятивного метода расширения и уравнения Стокса-Эйнштейна. Исправления для преломляющего индекса и вязкости растворителя были сделаны при помощи рефрактометра Эбби при 589 нм и Ubbelohde - капиллярном вискозиметре. Было невозможно выполнить измерения светорассеивания без NaCl с достаточной точностью из-за слишком низкой интенсивности рассеивания, как этообычно случается для водного раствора полиэлектролита без соли.
Измерение внутренней вязкости
Внутренняя вязкость [?]была определена, используя капиллярный вискозиметр Ubbelohde при 25°C. Время потока для воды было примерно 141 сек при 25°C. Термальная ванна
(Yamato Science, Inc. Токио, Япония), использовалась, чтобы отрегулировать температуру в пределах 25±0.02°C.
Динамические и статические вязкоупругие измерения
Динамические и статические вязкоупругие измерения были выполнены на установке RFSII
(Rheometrics Fluids Spectrometr; Rheometrics, Inc, NJ, США). Диаметр и угол конуса составляли 2.5 см и 0.1 радиан, соответственно. Напряжение составляло 5 % и угловые частоты колебались от 0.01 до 100 рад/сек в динамических измерениях. Сдвиг шкалы колебался от 0.01 до 1000 с-1 в статических измерениях. Температура была зафиксированной и составляла 20°C.
Измерения катушки в растворах ГН с мочевиной в 0.2 M NaCl растворе были изучены светорассеиванием. Радиус циркуляции (Rg), гидродинамический радиус (Rh) и отношение (Rg/Rh) в присутствии мочевины показаны вместе в присутствии сахарозы на рисунке 1.
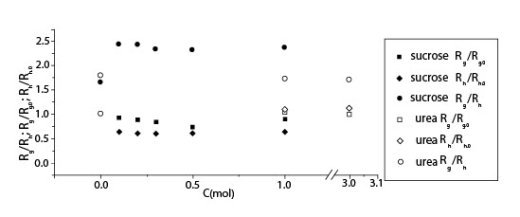
Иллюстрация 1. Радиус циркуляции и гидродинамический радиус ГН как функции концентрации добавленной мочевины и сахарозы в присутствии 0.2 M NaCl.
Результаты позволяют предполагать, что мочевина не вызывает значительных изменений катушки молекулы ГК в пределах экспериментальной ошибки, хотя наблюдались небольшие уменьшения в Rg и Rg/Rh. Эти результаты показывают явный контраст с нашими недавними результатами для растворов ГН с сахарозой в 0.2 M NaCl растворе, где и уменьшения Rg и Rh и увеличение Rg/Rh заметны с увеличением концентрации сахарозы. Величины Rg и Rh и небольшое уменьшение Rg/Rh с добавлением мочевины указывает, что молекулы ГК в форме расширенной катушки подвержены эффекту исключения объема, и растворимость ГК становится хуже с добавлением мочевины, вызывающей сокращение эффекта исключения объема. Никакое внутреннее взаимодействие между мочевиной и молекулами ГК, кроме эффекта исключения объема, не могло бы работать по крайней мере в экспериментальной
области концентраций, и уменьшение растворимости просто приводит к увеличению межмолекулярного взаимодействия. Поэтому, зависимость концентрации от ?sp0 была бы более сильной при добавлении мочевины в более разведенной области, и поведение в хаотичной области не было бы затронуто так присутствием мочевины (особенно без NaCl).
Было известно, что у молекул ГК есть обе гидрофильньные части, состоящие из экваториальных ОН групп сахаридов и гидрофобные части, состоящие из осевых CH групп. Водородные связи сформированы внутримолекулярно между продолжающимися моносахаридами и работают, чтобы укрепить молекулярные цепи ГК. Такая угловатость была недавно оценена количественно при помощи червеобразной модели цепи. После проведения ЯМР измерений было предложено, что угловатость цепей ГК в растворе появляется из-за внутримолекулярного формирования водородных связей. Было также предположено, что большинство жестких цепей выживают даже после изменения ионной силы, температуры или добавление мочевины; то есть, добавление мочевины не может эффективно разрушить внутримолекулярные водородные связи между молекулами ГК, но никаких экспериментальных данных в присутствии мочевины не было показано. Меньшая растворимость и большее межмолекулярное взаимодействие должно происходить из-за разрушения внутримолекулярных водородных связей, и размеры цепей должны уменьшиться намного больше, чем экспериментальные наблюдения. Присутствие NaCl могло бы понизить этот эффект мочевины.
Внутренняя вязкость
Для разбавленных растворов (C <C*), внутренняя вязкость была получена из закона Хаггинса: ?sp/C = [?]+ k'[?]2C. Таблица 1 показывает внутреннюю вязкость и константу Хаггинса k' для растворов с мочевиной в 0.2 M NaCl растворе. Без NaCl уменьшенная вязкость не давала прямую линию при низких концентрациях мочевины (меньше чем 1M) из-за сильного электростатического отталкивания, но подчиняется линейному отношению с концентрацией ГК и существенно уменьшается при высоких концентрациях мочевины, показывая линейную зависимость от концентрация ГК (1 М,3 М и 6 M мочевина). Это должно следовать из частичной защиты действия мочевины от электростатического отталкивания. Внутренние вязкости в воде много больше, чем в 0.2 M NaCl, полагают как следствие удлиненной молекулярной структуры и сохранения заметного электростатического взаимодействия. Внутренняя вязкость в 0.2 M NaCl уменьшалась с добавлением мочевины, но не зависела так сильно от концентрации мочевины. Постоянная Хаггинса k' для гибких молекул известна как 0.3-0.6. Когда k' больше, чем 1, в растворе должны существовать объемистые соединенные структуры.
Таблица 1. Внутренняя вязкость [?] и постоянная Хаггинса k' для растворов ГН с мочевиной в присутствии 0.2 M NaCl (Температура 25°C; молекулярный вес 1.6*106).
| urea | none | 1Murea | 3Murea | 6Murea |
| [?] (dl/g) | 24.8 | 18.6 | 19.0 | 21.8 |
| k' | 0.373 | 0.322 | 0.613 | 0.722 |
Динамические и статические вязкоупругие свойства
Характерная вязкость ?sp 1% растворов ГК в присутствии мочевины в различных концентрациях, а также с и без 0.2 M NaCl, как функция коэффициента сдвига, показана на рис. 2. Внутренняя вязкость растворов ГК без 0.2 M NaCl увеличивается с увеличением концентрации мочевины до 3 M, но в присутствии 6M мочевины было показано почти то же самое значение, как и в отсутствии мочевины, пока его не уменьшили добавлением 0.2 M NaCl. Это уменьшение следует из эффекта ограждения межмолекулярного электростатическое отталкивания и сжатия удлиненной цепи. Нужно отметить то, что величина ?sp не зависела так сильно от концентраций мочевины и NaCl в области утончения сдвига, в которой поведение отличается от поведения в ньютоновской области.
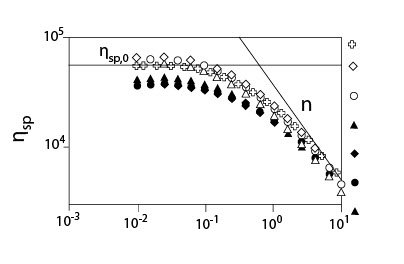
Иллюстрация 2. Зависимость внутренней вязкости от коэффициента сдвига для 1% растворов ГН с и без мочевины (Температура 20°C; Молекулярная масса 1.6*106).
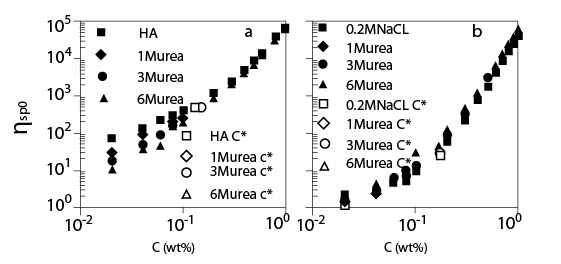
(a) Коэффициент сдвига внутренней вязкости для растворов ГН с и без мочевины, как функция концентрации ГН;
(b) Коэффициент сдвига внутренней вязкости для растворов ГН с и без мочевины в присутствии 0.2 M NaCl, как функция концентрации ГН (Температура 20°C; Молекулярная масса 1.6*106).
Рисунок 3 показывает концентрационную зависимость коэффициент сдвига внутренней вязкости ?sp0 для растворов ГК в присутствии мочевины различных концентраций без NaCl (a) и с 0.2 M NaCl (b). Вязкость раствора ГК без NaCl намного выше (больше, чем один порядок), чем с 0.2 M NaCl из-за электростатического взаимодействия. Рисунок 3 (a) показывает, что ?sp0 уменьшается в менее концентрированной области при добавлении мочевины, и ?sp0 более зависит от концентрации мочевины. Однако, в концентрированной сложной области ?sp0 совпадают друг с другом, зависимость концентрации ГК от ?sp0 кажется почти независимой от концентрации мочевины. Эти особенности также наблюдаются на рис. 3 (b) в присутствии 0.2 M NaCl. В обоих случаях (a) и (b), это очевидно, что добавление мочевины сильно не изменяло C* (или небольшое уменьшение C*) и значение ?sp0 в C *, где C* определено, как концентрация в точке перегиба ?sp0.
Рисунок 4 показывает критический коэффициент сдвига ?с, начала утончения сдвига, как функцию концентрации для растворов ГК с мочевиной без NaCl и с 0.2 M NaCl. Как показано для случая без NaCl, наблюдалось два режима, и они согласуются с результатами, приведенными на рисунке 3. В случае растворов ГК с мочевиной и NaCl были показаны графики зависимости ?сот концентрации в сконцентрированной области, потому что оценка ?с в разведенной области была вне экспериментального диапазона коэффициента сдвига. Цепь молекул ГК меньшего размера в присутствии 0.2 M NaCl приводит к большему значению ?с, чем без NaCl. Рисунок 5 показывает индекс псевдопластичности n, как функцию параметра наложения катушки С[?] для растворов ГК в присутствии мочевины различных концентраций с 0.2 M NaCl. Значение n было близко к 0.8 или больше, чем 0.8, для С[?] > 20. Об ограничивающем значении индекса псевдопластичности говорят, когда он составляет приблизительно 0.85 при С[?] > 20. В случае слабых гелей n, определено выше, чем 0.9. Полученные результаты идут как параллель с картиной, что растворы ГК в присутствии мочевины ведут себя, как хаотичные гибкие катушки, хотя и наблюдается угловатость цепи, которую нельзя не принимать в расчет.
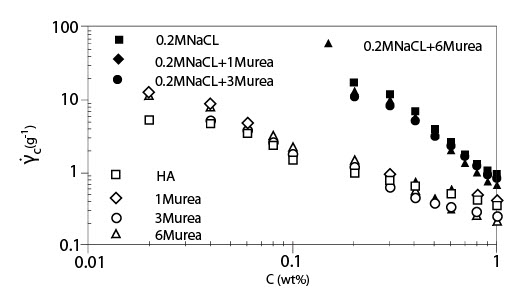
Иллюстрация 4.Критический коэффициент сдвига начала утончения сдвига как функция концентрации для растворов ГК в присутствии и отсутствии мочевины без NaCl и с 0.2 M NaCl. (Температура 20°C; Молекулярная масса 1.6*106).
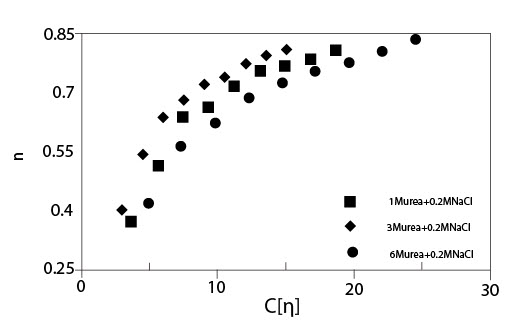
Иллюстрация 5. Индекс псевдопластичности n как функция параметра наложения катушки
С[?] для растворов ГН с мочевиной различных концентраций с и без 0.2 M NaCl (Температура 20°C; Молекулярная масса 1.6*106).
Сдвиг нуля характерной вязкости ?sp0, как функция параметра наложения катушки показал довольно хорошую суперпозицию для различных концентраций мочевины в 0.2 M NaCl растворе, как показано на рисунке 6. Наклоны в разведенной (C < C*) и сконцентрированной (C > C*) областях составляют 1.6 и 4.0 соответственно, а С*[?] и ?sp0 в точке C = C* оценены как примерно 3,2 и 24 соответственно. Эти значения согласуются с нашими предыдущими результатами. Любые другие внутренние характеристики при добавлении мочевины не исследовались.
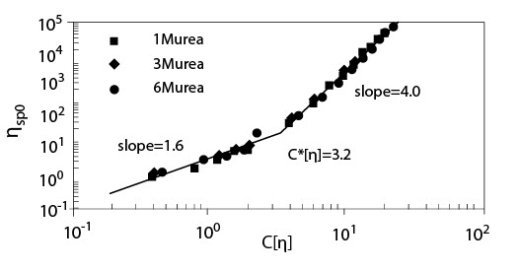
Иллюстрация 6. Сдвиг нуля характерной вязкости ?sp0 для растворов ГН с мочевиной в
присутствии 0.2 M NaCl, как функция параметра наложения катушки С[?] (Температура 20°C; Молекулярная масса 1.6*106).
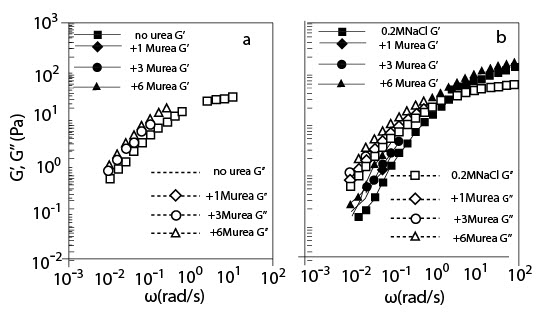
(a) Зависимость угловых частот G' и G" для l% раствора ГН с и без мочевины в различных концентрациях;
(b) Зависимость угловых частот G' и G" для l% раствора ГН с и без мочевины в различных концентрациях в присутствии 0.2 M NaCl (Температура 20°C; Молекулярная масса 2.02*106).
Рисунок 7 (a) и (b) показывает зависимость угловых частот от сдвига стабильного модуля G' и потерю сдвига модуля G'' для l % раствора ГК в присутствии мочевины без NaCl и с 0.2 M NaCl соответственно. При низкой частоте и G', и G" увеличились, а пересекающаяся частота G' и G" сдвигалась в сторону понижения угловых частот с увеличением концентрации мочевины. Подобное изменение наблюдалось и при добавлении сахарозы, однако, это было более резко выражено, чем изменение мочевиной; изменение мочевиной составляло менее, чем половину сдвига сахарозой. Хотя уменьшение пересекающейся частоты с добавлением мочевины могло бы соответствовать укреплению переходной структуры сети, сформированной запутанностью цепи, это не столь явно, как в случае сахарозы.
Увеличение G' (Рис. 7) и ?sp0 (Рис. 2) в 1% растворе ГК при добавлении мочевины могло бы быть приписано ломке межмолекулярных водородных связей между группами, отделенными многими промежуточными сегментами, идущими вдоль цепи, которые названы водородными связями дальнего расположения, используемыми для объяснения похожего увеличения внутренней вязкости раствора поливинилового спирта в присутствии мочевины.Однако, было невозможно обнаружить светорассеиванием изменение в радиусе циркуляции, не добавляя NaCl, и это должно быть темой исследования в будущем.
Были исследованы эффекты влияния мочевины на вязкоупругие свойства растворов ГК. Добавление мочевины уменьшает расширение молекулярных катушек ГК и способствует межмолекулярным взаимодействиям в разведенном растворе вероятно уменьшением эффекта исключенного объема из-за более плохих условий раствора. Присутствие NaCl могло понизить этот эффект мочевины. Напротив, в сконцентрированных и беспорядочных растворах мочевина почти не оказывает эффекта на реологическое поведение вообще. Добавление мочевины не затрагивает значительно предполагаемые водородные связи в молекулах ГК. Это открытие находится в остром контрасте с результатами, полученными при добавлении сахарозы к растворам ГК.