Абстракт
Норма ооцитарного оплодотворения прогрессивно уменьшается с увеличением времени интервала от овуляции. Это явление следует и параллельно постепенной дисперсии расширения кумулятивной массы, окружающей овулировавшие ооциты. Мышиные клеточно-ооцитарные комплексы (КОК), расширенные in vivo с FSH в присутствии сыворотки, подвергается разобщению так же как происходит in vivo с гонадотропин-стимулируемыми КОК. Метаболическая маркировка недавно синтезируемого гиалуронана (ГК) в этих условиях культуры позволила решить, что этот процесс зависит от распада матрикса и выпуска гиалуронана. В данной работе мы предоставляем доказательства, что увеличивающееся число множества клеток подвергается апоптозу после расширения, и что выпуск ГК из матрикса близко коррелирует с этим процессом. Кроме того, мы показываем, что, когда апоптоз экспериментально предотвращен, матрикс сохранен, и способность к оплодотворению у вложенного ооцита продлена.
Ключевые слова
Гиалуронан (ГК), апоптоз, оплодотворение, множество клеточно-ооцитарных комплексов (КОК).
Введение
Следуя эндогенному подъему LH-FSH или введению овуляторной дозы hCG, гранулярные клетки стенок увеличивают синтез протеолитических ферментов и продвигают формирование участка разрыва в стене фолликула. Наоборот, клетки, инвестируя ооцит, а именно, скопления клеток, синтезируют богатый муко-эластичный внеклеточный матрикс, который производит 20-40 увеличений объема скопления клеточно-ооцитарных комплексов (КОК), это процесс, который называют кумулятивным расширением или муцификацией. В овуляции расширенный КОК покидает фолликул через разорванную стену, в то время как зернистые клетки стенок остаются в фолликуле, формирующем желтое тело. Существенный компонент расширенного кумулятивного матрикса - гиалуронан (ГК). Объединенное действие гонадотропинов и ооцитарного растворимого фактора продвигает увеличение устойчивого постоянного уровня ГК синтазы 2 мРНК и синтеза ГК с молекулярной массой больше, чем 2 миллиона Дальтон (2-5 кДа). Анализ методом электронной микроскопии показывает, что длинные молекулы ГК переплетаются, организованы в искривленные волокна, которые формируют гомогенную петлеподобную сеть, заякоренную на поверхности множества клеток и проникающей в опоясывающую желточную оболочку ооцита. Белки являются существенными, чтобы организовать и сохранить ГК в таком высоко структурированном матриксе, так как протеазная обработка вызывает разобщение волокон в индивидуальные гиалуронановые нити и дисперсию массы кумулятивных клеток до одиночных клеток. Исследования in vivo и in vitro помогли идентифицировать ингибитор белка сыворотки, называемый интер-?–трипсин ингибитор (И?ТИ), как существенный элемент в удерживании ГК и кумулятивном расширении. Однако, еще не ясно, как этот белок действует, чтобы произвести такой эффект. Было выдвинуто предположение о вовлеченности в процесс высокоспецифичных ГК-связывающих белков, синтезируемых кумулятивными клетками. Действительно, увеличение устойчивого постоянного уровня TSG-6 мРНК происходит в КОК на протяжении расширения. Примечательно, что у белка, закодированного этой мРНК, есть способность связывать и ГК, и И?ТИ. Кумулятивные клетки также синтезируют белок CD44, который является рецептором ГК на поверхности клетки, вовлеченным в организацию перицеллюлярной муфты у нескольких типов клеток.
Когда у мышей кумулятивное расширение полностью (или частично) ингибировано, то значительно более низкое число КОК овулируются, и только некоторые из них могут быть оплодотворены. Поэтому, у кумулятивного расширения есть важная роль в процессе оплодотворения. Норма ооцитарного оплодотворения прогрессивно уменьшается с увеличением времени от овуляции и почти падает к нолю более, чем за 16 часов их постоянного нахождения в маточной трубе. Это снижение следует и параллельно постепенному ослаблению матрикса и сокращению размера кумулятивной массы. Когда КОК были исследованы методом электронной микроскопии во время этого промежутка времени, то некоторые из кумулятивных клеток показали признаки вырождения. Мышиные КОК, расширенные in vitro с FSH в присутствии сыворотки, подвергаются сокращению размера, так же как in vivo, стимулированные гонадотропином КОК. Метаболическая маркировка недавно синтезируемого ГК позволила решать, что это явление зависит от разборки матрикса и выхода ГК.
В данной работе мы изучили отношения между вырождением клетки и матриксной разборкой ГК, и возможность ооцита продлить способность к оплодотворению, ингибируя эти явления.
Материалы и методы
Изоляция и культура КОК
Зрелые 8-10-недельным швейцарским CD-1 мышам женского пола было введено 5 IU сыворотки гонадотропина беременной кобылы (PMSG) в 0.1 мл физиологического раствора. После 46-48 часов животные или были подвергнуты цервикальной (шейной) дислокации или им было введено 5 IU человеческого хондрионного гонадотропина (hCG), чтобы вызвать овуляцию. Яичники были собраны через 46-48 часов после инъекции PMSG в животных и перенесены в буферизованный раствор Hepes МЕМ, содержащий 1 мг/мл BSA. Компактные КОК были выпущены в среду путем прокалывания больших пазушных фолликул и собраны микропипеткой. Для каждой культуры 20 КОК были перенесены в 20 мкл МЕМ среды культуры, содержащей 0.3 мМ пирувата, 50 мкг/мл гентамицина, 3 мМ L-глутамина, 5% FBS и 20 нг/мл FSH или 1 мм dbcAMP, чтобы вызвать кумулятивное расширение. Культуры были выведены при 37°C в увлажненной атмосфере 5% CO2 в воздухе в течение времен, обозначенных в тексте. Для синтеза гиалуронана и исследования организации маркеры предшественников глюкозаминогликана были добавлены в начале культуры. Для морфологических исследований КОК, расширенных в естественных условиях, маточные трубы были собраны после 14 часов у объектов с hCG инъекцией (время овуляции) и в следующие разы как обозначено в тексте. КОК были выпущены путем прокалывания овидуктальной ампулы в МЕМ, содержащей 1 мг/мл BSA.
Качественный и количественный анализ апоптоза
КОК были инкубированы в течение 30 минут при 24°C с 4%-ым параформальдегидом в ПБС (pH 7.4). Затем они были интенсивно промыты ПБС и обработаны терминальным деоксинуклеотидилом с установленной трансферазой dUTP на конце зарубки, маркированным (TUNEL), чтобы показать разрывы ДНК. Клетки были обработаны в течение 2 минут с Тритоном X-100/PBS. После отмывкия в ПБС КОК были инкубированы в течение 60 минут при 37°C с ферментом терминальной деоксинуклеотидил трансферазой (TdT), в присутствии флуоресцеин изотиоцианат-спрягаемым dUTP (смесь реакции TUNEL). Отрицательные образцы контроля, которые были включены в каждое окрашивание, состояли из инкубирующихся КОК в смеси реакции TUNEL без фермента TdT. Для положительного контроля КОК сначала были обработаны с 1 мг/мл деоксирибонуклеазой I, чтобы вызвать ДНК переплетения разрывы, согласно методу TUNEL. Чтобы визуализировать хроматин, КОК были противоокрашены с 5 мкг/мл Hoechst 33258 в течение 5 минут и интенсивно промыты с ПБС. КОК были индивидуально перенесены в маленьком объеме на слайд и мягко спрессованы под покровным стеклом до тех пор пока кумулятивные клетки, рассеянные в трехмерной структуре матрикса, будут лежать в той же самой фокальной плоскости. Клетки были исследованы при помощи Olimpus Axioplan 2 микроскопа флуоресцентным способом. Клетки, показывающие гомогенное и умеренное окрашивание хроматина Hoechst всюду по всему ядру имели негативную реакцию TUNEL и поэтому при рассмотрении оказались не апоптозными клетками. Напротив, клетки с ядрами, содержащими сжатый хроматин, очень сильно окрашенный с Hoechst, который выглядел или окаймленным в массу, выровненную к ядерному конверту, или собранным в единственную массу, или фрагментированным в множество масс, которые образовались в кластерах, обязательно смежных друг с другом, имели положительную реакцию TUNEL и поэтому были определены, как апоптотические клетки.
Для количественного анализа апоптоза шесть случайных областей каждого КОК были проанализированы через 400-кратное усиление флуоресцентным методом. Общее количество апоптозных клеток было посчитано, а также вычислен процент апоптотических клеток для каждого КОК. Было проанализировано, по крайней мере, 10 КОК для каждого экспериментального образца. Данные были выражены как значения +/-SEM по крайней мере трех независимых экспериментов.
Количественный подсчет ГК
Количество ГК, синтезируемое в культурах было определено метаболической маркировкой, как описано в другом месте. Для каждого образца 20 КОК были культивированы в 20 мкл среды в присутствии [35S] сульфата (60 мСи/мл) и [3H] глюкозамина (100 мСи/мл). В конце каждого эксперимента была удалена жидкость из среды инкубации. Затем, среду и клеточно-матриксную фракцию обработали 20 мкл раствора для папаина (750 mlU финальная активность) в течение 1 часа при 65°C. Экстракция была закончена добавлением 1 объема 8 М гуанидин-HC1, содержащего 4 % (w/v) Тритона X-100. Каждый экстрагированный образец был нагрет до 100°C в течение 3 минут, чтобы инактивировать папаин, и растворен в 500 мкл добавлением раствора, содержащего 0.1 М Tris и 0.1 М ацетат натрия, pH 7.3. Затем процесс продолжился вымыванием на колонке Sephadex G50 (объем смолы 2 мл), уравновешенной 0.1 М Tris, 0.1 М ацетатом натрия и 0.5 % Тритоном X-100, pH 7.3. Аликвоты исключенного объема для каждого образца экстракции были обработаны хондроитиназой ABC (0.1 ед/мл) в течение 2 часов при 37°C. Определенное количество каждого такого образца было нанесено на хроматографическую колонку Sephadex G50 (объем смолы 4 мл), чтобы определить пропорцию радиомаркированных макромолекул, расщепленных ферментом. Оставшаяся часть каждого образца была проанализирована для его относительной пропорции ГК и ДС дисахаридов методом жидкостной хроматографией высокого давления (ВЭЖХ) на Partisphere РАС, уравновешенной с буфером ацетонитрил:метанол:вода в пропорции 52:12:36. Водный буфер содержал 0.5 М Tris, на 0.1 M борной кислоты, pH 8. Масса ГК, синтезируемого во время периода маркировки была определена, вычисляя специфическую активность комплексов UDP-N-ацетилгексозамин по шкале от 3H до 35S в ?Di-4S, полученного из DS. Радиоактивность была определена с Beckman LS 3801 счетчиком, с поправкой на исправления, определенные для стандартов 35S.
In vivo оплодотворение
Оплодотворение In vivo было по существу выполнено, как описано в другом месте. Кумулятивные защищенные или лишенные оболочки ооциты были перенесены в 100 мкл среды Whitten's с добавлением 15 мг/мл BSA. Впоследствии, 10 мкл суспензии спермы, содержащей 5-10 x 106 сперматозоидов/мл, были добавлены к культуре ооцитов. Сперматозоиды были получены из придатка яичка CD1-проверенного производителя и были подготовлены в течение 2 часов в той же самой среде, используемой для оплодотворения. После 6 часов ооциты наблюдались под интерференционным контрастным микроскопом и оплодотворенные были идентифицированы формированием двух проядер.
Результаты и обсуждение
Апоптоз кумулятивных клеток
Расширенные КОК, были взяты из мышиных яичниковых фолликул через 14 часов после эндогенной волны гонадотропинов или hCG инъекции в животных. После овуляции, КОК прогрессивно уменьшаются в размере, и полное обнажение всего ооцита происходит приблизительно через 30 часов после стимуляции гонадотропином. Когда КОК были исследованы методом электронной микроскопии, некоторые из кумулятивных клеток показали признаки вырождения. Мы показали, что эти клетки умирают через процесс апоптоза. В овуляции было найдено 2% апоптотических клеток/КОК, в то время как это значение увеличивается приблизительно в 8 и 15 раз соответственно через 17 и 20 часов после hCG инъекции. Подобный образец временного апоптоза происходит в КОК, стимулируемом FSH in vitro в присутствии FCS. При этих условиях культивирования норма апоптоза составляла 2% через 15 часов, когда полное кумулятивное расширение было достигнуто, и 10 % и 17 % соответственно после 20 и 24 часов культивирования.
Корреляция между апоптозом кумулятивных клеток и выходом ГК из матрикса
Стимулируемые FSH in vitro КОК, в присутствии FCS, начинают синтезировать ГК через 3 часа и прекращают это через 15 часов культивирования, когда полное расширение достигнуто (Рис. l). В это время почти весь (80-90 %) недавно синтезируемый ГК сохранен в матриксе. Прогрессивное высвобождение ГК из матрикса в среду культивирования происходит впоследствии, находя что-либо подобное апоптотическим событиям, описанным выше. Когда КОК культивируются в присутствии dbcAMP, синтез ГК стимулируется и ГК накапливается в матриксе со степенью временной зависимости, подобной наблюдаемому процессу с FSH. Однако никакое существенное количество ГК не выходит в среду между 15 и 28 часами культивирования КОК, стимулируемого dbcAMP (Рис. 2). Примечательно, что апоптоз не происходит в этих условиях культивирования. Вдобавок, как in vivo, кумулятивная целостность потеряна овулировавшими КОК, культивируемых in vitro после 14 часов в условии контроля (28 часов после hCG возбуждения), в то время как это сохраняется для КОК, культивируемых в течение того же самого периода времени в присутствии dbcAMP.
Эффект содержания матрикса кумулятивных клеток на оплодотворяемость ооцитов
Чтобы определить, могло ли бы содержание целостности матрикса кумулятивных клеток продлить способность к оплодотворению у ооцитов, норма оплодотворения овулировавших КОК, культивируемых в течение 14 часов с и без dbcAMP, была сопоставлена с теми из КОК, которые были осеменены вскоре после овуляции (контроль). Результаты показывают, что, когда КОК культивировались в отсутствии dbcAMP, норма оплодотворения спадала до 20 % контроля, в то время как, когда они культивировались в присутствии dbcAMP, норма оплодотворения составляла приблизительно 70 % контроля.
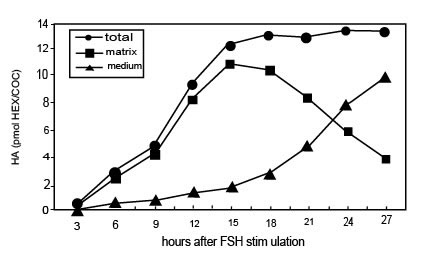
Иллюстрация 1. Временная зависимость синтеза ГК и его распределения между матриксом и средой в КОК, стимулируемой FSH in vitro.
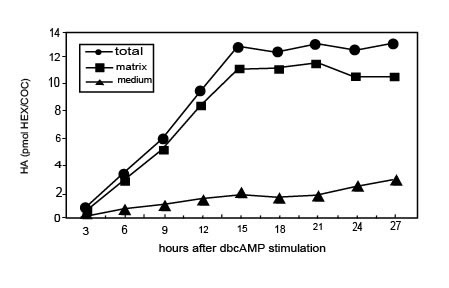
Иллюстрация 2. Временная зависимость синтеза ГК и его распределения между матриксом и средой в КОК, стимулируемой dbcAMP in vitro.
Заключение
В данной работе мы приводим доказательство того, что увеличивающееся число кумулятивных клеток подвергается апоптозу после расширения и то, что ГК освобождается от матрикса, близко коррелирует с этим явлением. Кроме того, мы показываем, что, когда апоптоз экспериментально предотвращен, матрикс сохранен, и способность к оплодотворению вложенного ооцита продлена. Эти результаты и будущие исследования на молекулярных механизмах, вовлеченных в дисперсию КОК, могут позволить оптимизировать условия культивирования тех ооцитов, используемых для помощи репродуктивным программам.
Подтверждения
Эта работа была поддержана грантом MURST от Национального проекта "Развитие и дифференцировка зародышевых клеток", и грантом CNR П.98.00512. СТ04.