Абстракт
Гиалуронан (ГК) вовлечен в процесс репарации ткани, но его роль во время повреждения брюшины пока еще плохо понята. Чтобы очертить его возможную роль, мы исследовали несколько аспектов метаболизма ГК in vitro в модели брюшинной раны. ЧБМК с прекратившимся ростом, собирающиеся вместе, были повреждены, и синтез ГК во время процесса ремонта был детерминирован [3H]-маркированным глюкозамином. После того, как начальный период задержки в 12 часов синтеза ГК de novo был отрегулирован 1.75±0.15-кратный (n=3) над контролем и оставался таким до восстановления монослоя. Цитохимическое окрашивание для UDP-глюкозы дегидрогеназы, было локализовано в клетках на краю раны, а также в тех клетках, которые мигрировали в рану. Используя метод ПЦР в реальном времени, мРНК для ГКС II, не был обнаружен в неповрежденных клетках, но при поражении монослоя, мРНК для ГКС II, был индуцирован, максимально через 12-24 часа после получения раны и оставался на повышенном уровне для до 144 часов. В контрасте, мРНК для ГКС III, было существенным перед раной, но ее экспрессия была уменьшена во время реституции раны. Эти результаты предполагают, что экспрессия ГКС II и ГКС III, дифференцированно отрегулированы в ответ на повреждение мезотелия.
В отдельном исследовании поврежденные клетки были в культуре с эндотоксином, свободным от ГК (250 000 Да). Включение ГК (диапазон 0-3.3 мкг/мл) увеличило норму перемещения клетки в зависимой от дозы манере. Этот ответ на ГК аннулируется предшествующим распадом ГК на дисахариды под действием гиалуронидазы Streptomyces.
Эти результаты предполагают, что ГК играет ключевую роль в ответе мезотелия на повреждение.
Ключевые слова
Гиалуронан (ГК), заживление ран, гиалуронан-синтаза (ГКС), уридин дифосфоглюкозо-дегидрогеназа (УДД)
Введение
Гиалуронан (ГК) - линейный несульфатированный глюкозаминогликан, синтезируемый клетками мезенхимы и составленный из повторения дисахаридных единиц N-ацетил-D-глюкозамин и D-глюкуроновой кислоты. Синтез ГК происходит в плазматической мембране и вовлекает ферменты уридин дифосфоглюкозо-дегидрогеназу (УДД) и гиалуронан-синтазу (ГКС) I, II и III. Фермент УДД преобразовывает UDP-глюкозу в UDP-глюкуронат, который впоследствии передается возникающему ГК, при помощи ГКС. Главным образом, ГК найден в соединительной ткани, где она может связаться с рецепторами поверхности клетки, например с CD44, рецептором для гиалуроновой кислоты опосредованной подвижности (РГКОП) и с протеогликанами аггреканом и версиканом. Несмотря на его простую структуру, ГК вовлекается во множество физико-химических и функциональных биологических процессов. Из-за присутствия заряженных остатков, гиалуронан может аккумулировать много молекул воды и таким образом может действовать как заполнитель пространств, смазка и гидратированный матрикс, через который могут мигрировать клетки. ГК, как также наблюдали, играл основную роль в перемещении клетки, быстром росте, эмбриогенезе, воспалении и раневых повреждениях.
Продолжающийся амбулаторный брюшинный диализ (ПАБД) теперь обычно используется как лечение последней стадии почечных заболеваний. Одно из последствий ПАБД - хроническое воспаление брюшины, которое приводит к обнажению мезотелия, к подверганию промежуточному потоку БД и, таким образом, к суб-мезотелиальному фиброзу. Недавние исследования продемонстрировали, что ГК играет основную роль в ответе брюшинной мембраны на химическое или бактериальное повреждение во время ПАБД. Ранее, мы сообщили, что уровень ГК увеличен в истраченных брюшинных жидкостях пациентов, подвергающихся ПАБД и то, что этот уровень далее увеличен во время перитонита и воспаления. Кроме того, успешное лечение перитонита приводит к возвращению уровня ГК назад к первоначальному. Мы также сообщили, что во время воспаления брюшины, поднятие уровня ГК приписывается частично увеличенному синтезу интерлeйкина-бета1. То, как ГК вовлечен в регенерацию мезотелия, необходимо определить. В этой статье мы используем установленную in vitro модель человеческих брюшинных мезотелиальных клеток, чтобы оценить причастность ГК к брюшинным раневым повреждениям и заживлениям. Мы сообщаем, что повреждение клетки приводит к дифференциальному регулированию ГКС II, увеличенному синтезу ГК во время инициирования мезотелиальной регенерации и что добавление внешнего ГК увеличивает норму регенерации монослоя.
Материалы и методы
Материалы
Все химикаты и реактивы имели самую высокую чистоту, коммерчески доступную. Гиалуронат натрия (молекулярная масса 2.5 x 105) был любезно подарен доктором Ове Вик (Фармация Офтальматикс, Упсала, Швеция) и был свободен от факторов роста и эндотоксина. Биотинилированный белок с гиалуронат-связывающей областью (ГСОБ) был любезно подарен нам профессором Майклом Бейлиссом, (Королевская Ветеринарная Школа, Лондон, Великобритания).
Клеточная культура
Человеческие брюшинные мезотелиальные клетки (ЧБМК) были получены из сальниковых экземпляров, используя установленные методы.
Синтез ГК de novo
До введения радиоактивной метки ЧБМК с остановленным ростом были один раз промыты ПБС, и монослой был поврежден внесением царапины при помощи стерильного стеклянного прута, как было ранее описано. Два метода использовались, чтобы следовать за синтезом [3H]-маркированного ГК. В первом клетки были инкубированы с сывороткой в свободной среде, содержащей [3H] - глюкозамин (25 мкСи/мл) для переменных периодов времени (0-144 часов). В выбранных временных точках среда культуры (СК) фильтровалась, и клетки были выделены из культуральных колб и инкубированы с 0.001 % (w/v) ЭДТА и 0.125 % (w/v) трипсином в течение 5 минут при 37°C. Во втором методе клетки маркировались в импульсном режиме для отборных периодов времени и клеток, выбранных из культуральной среды, как описано выше. В обоих подходах отдельные клетки были добавлены к СК и инкубированы с папаином (3.5 ед/мл) в отсутствии ЭДТА и цистеина при 65°C в течение 24 часов. Определенные количества образцов ГК были определены количественно высокоэффективной жидкостной хроматографией, и их гидродинамические размеры, проанализированы при разобщающих условиях на Sephacryl S-1000. Чтобы подтвердить присутствие ГК, образцы были инкубированы с 10 ед/мг гиалуронидазы Streptomyces.
Оценка деятельности уридин дифосфоглюкозо-дегидрогеназы (УДД)
ЧБМК, выращенные в 35-миллиметровых плашках, были повреждены, как описано выше, и деятельность УДД и контроля, и поврежденных клеток, была оценена согласно методу Мехдизаде и др. до восстановления монослоя.
Гистохимическое окрашивание свободного ГК
Повреждение и контроль ЧБМК были культивированы на стеклянном покрытии и в выбранных точках времени, быстро промыты ПБС и фиксированы холодным ацетоном в течение 2 минут. Клетки были инкубированы с ХАБР согласно методу Пициллидес и др.
Извлечение РНК и ПЦР в реальном времени для ГКС I, ГКС II и ГКС III
Общая РНК от контроля или поврежденных была извлечена в выбранных точках времени, используя изолятор РНК (Genosys, Кембридж, Великобритания) согласно инструкциям изготовителей. Равное количество полной РНК (1 мкг) от каждого образца было первоначально полностью подвергнуто обратной транскрипции в кДНК, используя Суперскрипт RNase H обратную транскриптазу и случайные гексамеры (гексадеоксирибонуклеотиды, пд[N]6, 100 мкм, Pharmacia). Равные объемы (2 мкл) продуктов обратной транскрипции затем были подвергнуты амплификации методом ПЦР. Чтобы подтвердить, что равное количество кДНК использовалось и полуколичество продуктов ПЦР, ?-actin использовался как 'вспомогательный' ген (25 циклов). Последовательности праймеров были разработаны следующим образом:
Праймер ___________ Последовательность _______ Размер Последовательности
a-актин (прямой) 5 '-GGAGCAATGATCTTGATCTT-3'
a-актин (обратный) 5 '-TCCTGAGGTACGGGTCCTTCC-3' 204 по
ГКС I (прямой) 5 '-AGCAGGACGCGCCCAAGCCCACTC-3'
ГКС I (обратный) 5 '-CTTCTTATTCTTGTTCTTTAGCGA-3' 562 по
ГКС II (прямой) 5 '-TCCCGGTGAGACAGATGAGT-3'
ГКС II (обратный) 5 '-ACCCGGTTCGTGAGATGC-3' 495 по
ИМЕЕТ III (прямой) 5 '-AGTGCAGCTTCGGGGATGA-3'
ИМЕЕТ III (обратный) 5 '-TGATGGTAGCAATGGCAAAGAT-3' 453 по
После амплификации 10 мкл каждой реакционной смеси ПЦР были проанализированы методом электрофореза на планшете в агарозном геле (3 % w/v) в буфере lx Трис-ацетат-ЭДТА, содержащем этидий бромид (0.5ue/ml) при 70 В в течение 2.5 часов. Впоследствии гели были сфотографированы, а плотность групп была оценена, используя денситометр негативов BioRad, и выражена как отношение специфического праймера к a-актину.
Добавление внешнего ГК к поврежденным ЧБМК
ЧБМК были выращены до слияния в 35-миллиметровых плашках, рост приостановлен в течение 72 часов, а повреждения внесены, как описано выше. Клетки культивировались с (a) свободной среде с сывороткой, (b) ГК (50 - 3300 нг/мл) (c) ГК (3300 нг/мл), предварительно обработанном гиалуронидазой с Streptomyces (10 mU), и подвергнутой кипению в течение 5 минут и (d) одним ферментом после кипения. 10%-ый ФЦС использовался как средство контроля. Закрытие оголенной области было проверено, используя инвертированный микроскоп Axiovert 135, с М. нагревающейся стадией. Данные были проанализированы, используя программное обеспечение BioVisions (Improvisions Ltd, Великобритания).
Определение роста и жизнеспособности клеток
Темпы роста клеток были определены, используя метод MTT. Токсичность клеток оценена измерением молочнокислой дегидрогеназы, выпущенной в межклеточную среду, как ранее описано нами для мезенгиальных клеток.
Результаты и обсуждения
В предыдущем исследовании мы продемонстрировали, что при механической ране, сделанной в сливающихся неподвижных монослоях ЧБМК, клетки с края раны мигрируют к её центру с восстановлением монослоя, достигаемого в пределах 72 часов. Так как ГК-обогащенный матрикс, как известно, имеет сильное воздействие на клеточное движение, мы определили, был ли ГК вовлечен в миграционное поведение поврежденного монослоя ЧБМК. Чтобы достигнуть этого, мы определили уровень экспрессии мРНК для ГКС I, ГКС II и ГКС Ш, используя полуколичественный метод ПЦР в реальном времени. Данные продемонстрировали, что при нормализации ?-актина, было увеличение экспрессии мРНК ГКС II через 6 часов после поражения и что это было максимально между 12-24 часами (15-кратное увеличение по контролю, см. иллюстрацию 1). После этого ее экспрессия уменьшилась, и после 48 часов для мРНК для ГКС II она вернулась к прежнему уровню, который только немного выше, чем уровень экспрессии в контроле у неподвижных клеток. В сравнении, пока уровень мРНК для ГКС III, был постоянным в нормальных клетках, небольшое снижение его уровнях наблюдалось через 6 часов после раны (иллюстрация 1). Максимальное сокращение ГКС III наблюдался после 24 часов (6-кратное сокращение по сравнению с клетками контроля). Уровень мРНК для ГКС Ш возвращается к начальному уровню через 96 часов. Эти результаты были последовательны в трех различных экспериментах с тремя различными линиями клеток.
Экспрессия мРНК для ГКС I не была обнаружена ни в контроле, ни в поврежденных культурах ЧБМК (до 40 циклов). Те же самые праймеры для ГКС I, однако, успешно продемонстрировали происхождение генных продуктов ГКС I от РНК из человеческих лимфоцитов (данные не показаны). В течение экспериментов мы определили, было ли механическое повреждение вредно для клеток. Определенное количество каждого супернатанта в течение эксперимента было проанализировано на предмет выпуска молочнокислой дегидрогеназы. Мы не продемонстрировали изменения в выпуске молочнокислой дегидрогеназы во время контроля и повреждения клеток.
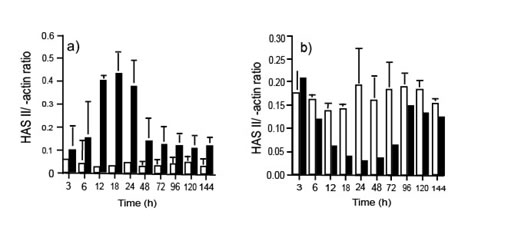
Иллюстрация 1. Денситометрические отношения (a) ГКС Ш/?-actin, и (b) ГКС Ш/?-actin после ПЦР в реальном времени полной РНК, извлеченной из неповрежденных (?) и поврежденных (?) клеток (n=3).
Временный синтез ГК в ответ на повреждение в культуре ЧБМК
Никакого изменение в de novo синтезе ГК не наблюдалось в контроле и поврежденных клетках во время начальных 12 часов, но после этого, [3H]-ГК синтез в поврежденных монослоях увеличился до максимума, наблюдаемого между 18 и 24 часами (иллюстрация 2).
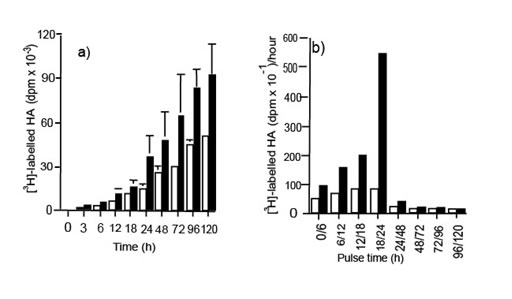
Иллюстрация 2. Синтез [3H]-ГК de novo в клетках контроля (?) и поврежденных клетках (?) ЧБМК. (a) Общее количество ГК, накопленного в выбранных точках времени были определены объединением [3H]-глюкозамина в папаин переваренный и устойчивостью к гиалуронидазе [3H]-макромолекулы (n =3). (b) Контроль и поврежденные клетки были маркированы [3H]-глюкозамином в импульсном режиме в течение обозначенного времени. Данные - среднее число двух экспериментов.
Гель-фильтрационная хроматография маркированного ГК, очищенного от контроля и поврежденных монослоев не показала различия в их гидродинамическом размере (иллюстрация 3).
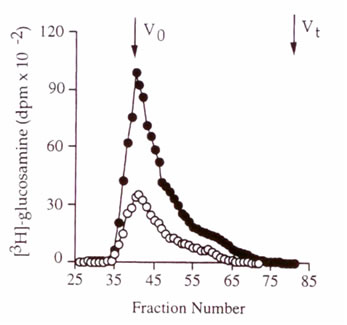
Иллюстрация 3. Гель-фильтрационная хроматография [3H]-ГК из контроля (?) и поврежденных клеток (?). Не наблюдалось никакого различия в их молекулярном весе.
ГК синтез в переднем крае раны
Локализация ГК синтеза в поврежденных монослоях была достигнута УДД цитохимическим окрашиванием. Во время повреждения (t=0) наличие продукта реакции для УДД было очевидно всюду по культуре, но по прошествии 24 часов заметное наличие продукта реакции наблюдалось в переднем крае и в клетках, входящих в рану. Эта расширенная деятельность для УДД была также очевидна после 72 часов в области контакта между двумя продвигающимися краями. При исследовании с ХАБР подобный образец наблюдался для выявления местоположения ГК. Этот образец окрашивания не наблюдался в культурах, предварительно обработанных гиалуронидазой Streptomyces (данные не показаны).
Закрытие раны ЧБМК ускорено в присутствии ГК
Концентрация ГК, как показывали, была значительно увеличена в брюшинных водах, собранных у пациентов ПАБД во время эпизодов перитонита. Эти данные позволяют предположить возможную роль этого гликозаминогликана в ответ на брюшинное воспаление и раневые повреждения. Чтобы выяснить это, мы исследовали эффект ГК на норме перемещения клеток в поврежденных культурах сливающихся ЧБМК. Внешний ГК в дозах в диапазоне, обнаруженном в брюшине зараженной и незараженной жидкости (50-3300 нг/мл), был добавлен к клеткам, и оценена норма перемещения клетки до восстановления монослоя. Мы наблюдали увеличение нормы ЧБМК, мигрирующих в рану в зависимой от дозы манере (иллюстрация 4). Дисахариды ГК, полученные из обработки ГК с гиалуронидазой Streptomyces, не увеличивали перемещение ЧБМК, так же как и фермент в одиночку.
Заключение
В этом исследовании мы продемонстрировали, что реституция брюшинного мезотелиального монослоя сопровождается увеличением синтеза ГК. Увеличение синтеза ГК было локализовано в клетках в переднем крае раны и в клетках, мигрирующих в оголенную область. Был продемонстрировано, что мРНК для ГКС II вовлечена в процесс восстановления, в то время как для мРНК для ГКС Ш было показано только то, что она присутствует, когда монослой полностью оправился от повреждения.
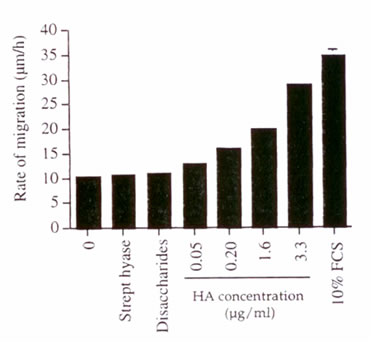
Иллюстрация 4. Эффект внешнего ГК на норму перемещения ЧБМК после раны. Эндотоксин - свободный ГК (0 - 3.3 мкг/мл), ГК предварительно обработанный гиалуронидазой Streptomyces и денатурированной гиалуронидазой были добавлены к поврежденной культуре ЧБМК. Норма перемещения клеток была вычислена согласно Материалам и Методам. 10%-ый ФЦС применялся в качестве надежного контроля. Результаты выражены как значение ± SD (n = 3).
Подтверждение
Проект поддержан грантом (044838/Z/95/Z) от Фонда Wellcome и Почечного Фонда Исследования Уэльса. Все данные с добрым разрешением от Международного Почечного Центра.