Абстракт
Компонент внеклеточного матрикса (ВКМ) гиалуронат (ГА) физиологически существует в виде высокомолекулярного полимера (ВМ-ГА), но он расщепляется в участках воспаления, где будет контактировать с дендритными клетками (ДК). Для определения эффектов ГА на ДК, были созданы ГА-фрагменты разного размера. Только малые ГА-фрагменты размером с тетра- и гексасахариды (мГА), но не средние фрагменты (СР-ГА, мол. масса 80-200 кДа) и не ВМ-ГА (мол. масса 1000-600 кДа), вызывали иммуннофенотипическое созревание ДК из человеческих моноцитов (повышение уровня HLA-DR, B7-1/2, CD83, понижение уровня CD115). Таким же образом, лишь мГА способствовали увеличению продукции дендритными клетками цитокинов IL-1?, TNF?, IL-12 и их аллостимулятрной способности. Эти эффекты были высокоспецифичны для мГА, так как они отсутствовали у других гликозаминогликанов (ГАГ), таких как хондроитинсульфат (ХС) или гепарансульфат (ГС) или продуктов их фрагментации. Интересно, что в мГА-индуцированном созревании ДК не принимают участие рецепторы CD44 или RHAMM, поскольку ДК из мышей с отсутствием CD44 и из мышей дикого типа одинаково отвечали на стимуляцию мГА, тогда как рецептор RHAMM отсутствует в ДК. Полученные данные позволяют предположить, что взаимодействие ДК с малыми ГА-фрагментами во время воспаления вызывает созревание ДК.
Ключевые слова
Дендритные клетки, стимуляция Т-клеток, CD44, RHAMM
Введение
Гиалуронан (ГА) – это повсеместно распространенный компонент внеклеточного матрикса (ВКМ), присутствующий в высоких концентрациях в коже, где он синтезируется в первую очередь дермальными фибробластами и эпидермальными кератиноцитами. В нормальной коже ГА существует в виде высокомолекулярного (600-1000 кДа)(ВМ-ГА) несульфатированного гликозаминогликана (ГАГ), состоящего из повторяющихся фрагментов Д-глюкуронового ацид-Н-ацетил-Д-глюкозамина. Функциональные свойства ВМ-ГА заключаются в поддержании и гидратации кожного ВКМ, а также связывании с различными факторами роста и ГАГ меньшего размера.
Физиологическая деградация ВМ-ГА в коже включает захват кератиноцитами, который производится с участием высокоаффинного ГА-рецептора CD443,4, и внутриклеточную фрагментацию на фрагменты среднего размера (СР-ГА 300-60 кДа). Фрагментированный ГА выходит из кератиноцитов, проходит через базальную мембрану и высвобождается в лимфатические сосуды, не подвергаясь в дальнейшем особенному катаболизму дермальными клетками. Эти фрагменты распадаются в кожных лимфатических узлах. Во время воспаления, выделяемые тромбоцитами хемотаксические факторы, такие как фибрин, стимулируют поступление и активацию фибробластов. Эти клетки напрямую разрушают окружающие компоненты ВКМ путем секреции гиалуронидазы, в результате чего повышаются тканевые концентрации малых ГА-компонентов (мГА) 7,8. Более того, расщепление могут вызывать активные формы кислорода, выделяемые, например, гранулоцитами, или в УФ-облученной коже, показывая, что разные провоспалительные стимулы могут вызвать неспецифическую деградацию ГА 9,10.
Во время кожные иммунных ответов антиген-презентирующие клетки (АПК) подобно ДК проникают в кожу, где встречаются с антигеном. Этот процесс включает в себя приток предшественников ДК из кровяного русла, а также миграцию антиген- содержащих ДК, находящихся в эпидермисе, клеток Лангерганса (КЛ), в дерму 11,12. Затем ДК перемещаются из дермы в лимфатические сосуды и проникают в местные лимфоузлы для проявления специфического Т-клеточного ответа путем презентирования антигена в связи с молекулами MHC I и MHC II. Во время этого процесса происходит активация ДК, связанная с четкими изменениями в фенотипе и функции, которая носит название созревания ДК. Эти процессы созревания могут быть воспроизведены при культивировании ДК in vitro из клеток-предшественников в среде, содержащей GM-CSF и IL-4, путем добавления «стимулов к созреванию», таких как LPS, TNF?, моноцит-регулируемая среда (МРС) или связывание с CD-4013,14. Зрелые человеческие ДК имеют неприкрепленный дендритный фенотип, синтезируют отдельные поверхностные маркеры, такие как CD1a и CD8315, но у них отсутствует CSF-1 рецептор CD115 13,14. Эти фенотипические изменения, в том числе включающие высокую экспрессию MHC I и MHC II, а также костимулирующих молекул В7-1, В7-2 и CD40, приводят к повышению способности стимулировать спящие Т-клетки11,12.
В данной работе мы исследовали эффекты ГА-фрагментов разного размера на ДК и установили, что ГА-фрагменты малых молекулярных весов, но не СР-ГА или ВМ-ГА, эффективно и специфично вызывают созревание человеческих и мышиных дендритных клеток.
Материалы и методы
Среды и реагенты
К культуральной среде RPMI-1640 добавляли 1% пенициллина/стрептомицина, 1% L-глутамина (All Seromed, Берлин, Германия) и 1 % ЧСА (Bayer, Мюнхен, Германия). Все реагенты, среды и буферы, использованные в экспериментах, были проверены с помощью анализа лизата амебоцитов Limulus (LAL); содержание эндотоксинов составило менее 0.06 ЕЭ/мл, что соответствует стандарту Европейского Сообщества для растворов и инъекций. Полимиксин В, катионный антибиотик, вымещающий Са2+ их анионных фосфолипидов, приобретен в Calbiochem, Бад Соден, Германия. Хондроитинсульфат С из акульего хряща для клинического применения был любезно предоставлен Sankyo INC., Мюнхен, Германия, и был подвергнут ферментативному расщеплению с помощью 10 ед. хондроитиназы АВС из Proteus vulgaris (Sigma, Дейзенхофен, Германия) на ночь. Гепарансульфат натрия Braun 10.000 ед. (Braun, Мельсунген, Германия) для клинического применения был обработан 2 ед. гепариназы III из Flavobacterium heparinum (Sigma) при 37°С. Глиоксаль и глицеральдегид были приобретены в Sigma. Поликлональная кроличья-анти-мышиная RHAMM-сыворотка и поликлональная кроличья-анти-человеческая RHAMM-сыворотка описана в других работах 16.
Приготовление человеческих ДК
Моноцитные клетки были выделены из светлого слоя кровяных сгустков здоровых доноров по Ficoll-paque plusTM градиенту (Pharmacia, Фрайбург, Германия), не содержащему эндотоксинов, и инкубировались в течение 45 минут с неактивирующими анти-человеческими-CD14 MACSTM-мечеными моноклональными антителами (Milteny Biotech, Бергиш Гладбах, Германия). CD14+ клетки были очищены методом магнитной сортировки клеток с использованием MACS-systemTM (Milteny). 5x106 моноцитов на лунку были рассажены в 6-луночные плоскодонные планшеты (Costar, Боденхейм, Германия) и культивировались в течение 4 дней в среде RPMI 1640 (GIBCO BRL, Эггенштайн, Германия) с добавлением 5% человеческого сывороточного альбумина (Bayer Diagnostics, Мюнхен, Германия), проверенного на содержание эндотоксинов, 1000 ед./мл GM-CSF (LeukomaxTM, Novartis, Нюрнберг, Германия) GCP/GMP качества и 100 ед./мл IL-4 (любезно предоставленного Shering-Plough, Нью-Йорк, США) при 37°С, 5% СО2.
Получение мышиных ДК из костного мозга
ДК были получены по методу Инаба и др.17, с незначительными изменениями. Костный мозг отбирали из большеберцовой и бедренной кости С57BL/6 мышей (n=4). Клетки были ресуспендированы в концентрации 1х106 клеток/мл в среде cRPMI-1640 (Gibco) с 40 нг/мл GM-CSF и 100 нг/мл IL-4 (оба из PromoCell, Хайдельберг, Германия). Клетки подкармливали на 3 и 5 день культивирования замещением половины среды в каждой лунке свежей сRPMI с GM-CSF и IL-4. На третий день не прикрепившиеся клетки были удалены, после чего планшет аккуратно встряхнули. Плохо прикрепленные клетки, включая ДК, аккуратно собирали пипеткой на 6 день. ДК были однократно промыты и ресуспендированы в концентрации около 5х105 клеток/мл в cRPMI. На дно 14 мл пробирки с коническим дном (Becton Dickinson) добавили 2 мл 14.5% метризамида (Boehringer Ingelheim, Хайдельберг, Германия), и 8 мл клеточной суспензии центрифугировали при комнатной температуре (22°С) в течение 20 минут при 600 х g. Хорошо осевшие клетки собрали, дважды промыли и ресуспендировали для использования. Степень очистки Iab положительных клеток составила >70% по данным проточной цитометрии.
Приготовление ГА-фрагментов
Гиалуроновая кислота (HEALONTM) для клинического применения (содержание эндотоксинов менее 0.1 нг/мг) была любезно предоставлена фирмой Pharmacia, Эрланген, Германия. Из HEALONTM были получены два вида ГА-фрагментов: 1) СР-ГА были приготовлены в течение 2 минут на льду с использованием ультразвукового разрушителя Branson с выходом, ограниченным точностью микропипетки, как описано18. Затем пробы были разделены на 0.5% агарозном гель-электрофорезе и визуализированы с помощью катионного красителя Stains All (3,3’-диметил-9-метил-4,5,4’,5’-дибензотиакарбоцианин, BioRad, Мюнхен, Германия), как описано19. 2) малые ГА-фрагменты (мГА) были получены ферментативным расщеплением СР-ГА гиалуронидазой из бычьих яичек (Sigma) в течение 12 часов в 1 М натрий-ацетатном буфере рН 5.0, 37°С. Фрагменты были разделены на 3,5 x 115 см колонке Biogel P10 (BioRad) на ночь. Пробы собирали с колонки в течение 12 часов по 20 минут каждая. Концентрация ГА в каждой пробе была определена путем добавления уроновой кислоты, как описано20, и фотометрической детекции при 520 нм против дистиллированной воды. Размер ГА-фрагментов в каждой пробе определяли методом ANTS-мечения и анализировали в 30% акриламидном гель-электрофорезе 21.
Выделение Т-клеток/Анализ Т-клеточной пролиферации
Спящие Т-клетки были получены из CD14-истощенной клеточной фракции PBMC. Оставшиеся антиген-презентирующие клетки были удалены путем положительной селекции с использованием моноклональных антител против HLA-DR (Клон НВ 145) и CD11b (ОКТ-6)(оба из АТСС) в течение 45 минут при 4°С, отмыты в фосфатном буфере, после чего инкубировались со вторичными козлиными-анти-мышиными DynalTM-мечеными моноклональными антителами в тех же условиях (Dynal, Гамбург, Германия). Методом проточной цитометрии показана чистота CD3+ клеток >85%, количество HLA-DR положительных клеток составило менее 1 %, и клетки не отвечали на РНА-стимуляцию (10 нг/мл). Немеченые CD3+ клетки собрали после магнитной сортировки, отмыли и рассадили в концентрации 1х106 клеток на лунку с 5х104 на лунку зрелых аллогенных ДК в круглодонные 96-луночные планшеты (Costar). На четвертый день добавили [3H]-тимидин (Amersham, Фрайбург, Германия) в количестве 1 ?Ки на лунку в течение последних 18 часов культивирования. Окончательно радиоактивность была определена методом жидкостной сцинтилляционной спектроскопии (Canberra Packard, Дрейейх, Германия).
ПЦР с использованием обратной транскриптазы
Общее количество РНК выделили из дендритных клеток и RHAMM положительной линии рака молочной железы T47D16 с использованием набора quick-prep (Pharmacia, Эрланген, Германия) в соответствии с указаниями производителя. кДНК была синтезирована из 5 мкг общего количества РНК с использованием обратной транскриптазы Superscript II (Gibco, Эггенштайн, Германия). Продукт реакции использовали для ПЦР с Taq-ДНК-полимеразой (Gibco) на 30 циклов при 94°С 1 мин., 72°С 2 мин., 55°С 3 мин. Аликвоты продуктов ПЦР реакции по 25 мкл анализировали в 1% агарозном гель-электрофорезе. Праймеры были получены на основе последовательности, опубликованной Ассманном и др.16:
Нижний праймер: Поз.951: 5’ CAG GAA TAG AGA ACA CAA CG 3’
Верхний праймер: Поз.1719: 5’ TCT TCC TTC TTC ATC TTC CAG C 3’
Результаты
Мы использовали ГА-препараты трех различных размеров; ВМ-ГА (HEALONTM, не содержащий эндотоксинов), разрушенный ультразвуком HEALONTM, образующий фрагменты среднего размера (СР-ГА), малые ГА-фрагменты (мГА), полученные путем расщепления СР-ГА гиалуронидазой. 0,5% агарозный гель-электрофорез ВМ-ГА и СР-ГА показал, что их молекулярные массы составляют 1000-200 кДа и 200-80 кДа, соответственно (Рис. 1А). Препарат мГа в дальнейшем разделили на колонке с полиакриламидным гелем и собрали фракции элюции с 20-минутным интервалом. 30% акриламидный гель-электрофорез показал, что фракции, собранные раньше, содержали более крупные олигосахариды, например, фракция №12 состояла из фрагментов размером в 4-14 олигосахаридов (Рис. 1Б), тогда как пробы, собранные позднее, содержали лишь малые фрагменты, например, фракция №22 состояла из фрагментов размером в 4-6 олигосахаридов (Рис. 1Б). Для экспериментального применения, три фракции, охватывающие набор различных размеров длиной от 4-14 олигосахаридов были разведены до концентрации олигосахаридов 1 мг/мл. Поздние фракции, не содержащие фиксируемого количества ГА, играли роль отрицательного контроля.
Действие разных препаратов ГА на иммуннофенотип ДК из человеческой крови определяли методом проточной цитометрии. 4-дневные незрелые ДК демонстрировали высокую экспрессию CD1a, CD44, ICAM-1 на поверхности, средний уровень экспрессии B7-1, B7-2, HLA-DR и CD115, тогда как экспрессия CD83 была незначительной (данные не показаны). В результате стимуляции тремя различными фракциями мГА в течение 48 часов наблюдались зависимые от дозы фенотипические изменения в ДК, включая заметное повышение уровня HLA-DR, B7-1, B7-2, ICAM-1 и CD83, а также снижение уровня CD1a и CD115 (данные не показаны). Обнаружено, что концентрация мГА 10 мкг/мл точно соответствовала фенотипическому созреванию, вызванному в тех же ДК обработкой 10 мкг/мл LPS в течение 48 часов. Интересно, что фракции мГА, содержащие 4-16, 4-10 или 4-6 олигосахаридов, оказывали одинаковое действие. Эксперименты по подбору дозы показали, что 10 мкг/мл каждой из фракций мГА вызывали полное фенотипическое созревание ДК (данные не показаны). Это позволяет предположить, что фрагменты мГА размером в 4-16 олигосахаридов, присутствующие во всех фракциях (Рис. 1Б), в первую очередь ответственны за созревание ДК. Однако ранние фракции содержали относительно меньше фрагментов из 4-6 олигосахаридов. Следовательно, нельзя исключать, что фрагменты мГА из 8-16 олигосахаридов также могут проявлять активность.
Для сравнения, ВМ-ГА или СР-ГА, полученные из того же самого HEALONTM, не содержащего эндотоксинов, в высокой концентрации 100 мкг/мл не оказывали действия на ДК. Кроме того, ДК не подвергались контролю на колонке, не содержащей детектируемого количества ГА, что исключает возможность индукции созревания ДК компонентами геля Biogel P10 (данные не показаны). Созревание, стимулированное мГА-фрагментами, отличалось продолжительностью и необратимостью, так как ДК, обработанные мГА, можно было культивировать до 14 дня без дополнительного добавления IL-4 и GM-CSF, при этом они сохраняли свой фенотип (данные не указаны).
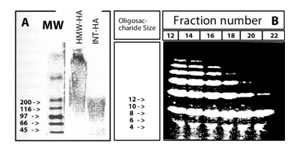
Иллюстрация 1. Характеристика препаратов ГА А) 0.5% агарозный гель-электрофорез показал, что молекулярные массы ВМ-ГА составляют 1000-200 кДа, СР-ГА 200-80 кДа.
Б) Фракции, содержащие олигосахариды мГА в 30% полиакриламидном гель-электрофорезе. Фракции, собранные ранее, содержат более крупные олигосахариды, тогда как фракции, собранные позднее, содержат только малые фрагменты.
Поскольку фенотипическое созревание ДК сопровождается повышенной продукцией провоспалительных цитокинов 11,12, мы провели эксперименты ELISA для определения содержания цитокинов в надосадочной жидкости мГА-стимулированных ДК. Те же три фракции мГА, но не ВМ-ГА, СР-ГА или контроль на колонке, повысили продукцию IL-1? и TNF? в зависимости от дозы подобно действию LPS (Рис. 2 и Таблица I). Мы установили, что мГА при концентрации 10 мкг/мл эффективно вызывают значительное повышение TNF?; насыщение происходило при концентрации выше 50 мкг/мл (Таблица I). Напротив, добавление мГА вызвало лишь слабое повышение IL-12 в сравнении с LPS (Рис. 2). Заметим, что ни мГА, ни LPS не оказывали влияние на продукцию IFN? или IL-4 дендритными клетками (данные не показаны).
Созревание ДК также сопровождается повышенной способностью к стимуляции иммунных ответов, обусловленных Т-клетками, in vitro и in vivo 15,16. Для того чтобы проверить влияние мГА на данные функциональные свойства, мы в первую очередь оценили способность человеческих ДК стимулировать пролиферацию спящих аллогенных Т-клеток в стандартном MLR. мГА в концентрации 10 мкг/мл, подобно LPS, значительно повышали аллостимуляторный потенциал ДК (Рис. 3). Опять же, эту стимулирующую активность обеспечивали фрагменты мГА размером 4-16 олигосахаридов (Рис. 3).
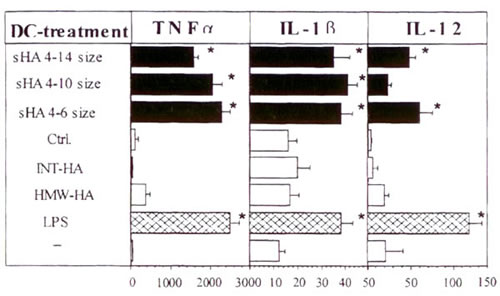
Иллюстрация 2. МГА повышает продукцию цитокинов ДК Четырехдневные ДК инкубировали в течение 48 часов с 20 мкг/мл препаратов мГА (черные столбцы), 10 мкг/мл LPS (структурированные столбцы), ВМ-ГА, СР-ГА, ничем не обработали (-) или поставили как контроль на колонке (Ctrl.) (белые столбцы). Эксперименты ELISA ставили на бесклеточных надосадках на предмет содержания IL-1?, TNF?, IL-12 и IFN?. Результаты показаны в пг/мл +/- СО по триплетным лункам. * Р>0.001 по сравнению с необработанными ДК (-).
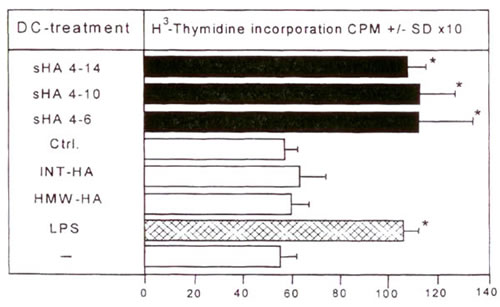
Иллюстрация 3. ДК, стимулированные мГА, повышают Т-клеточную пролиферацию ДК предварительно обработали 20 мкг/мл мГА (черные столбцы), 10 мкг/мл LPS (структурированные столбцы), ВМ-ГА, СР-ГА, ничем не обработали (-) или поставили как контроль на колонке (Ctrl.) (белые столбцы) и инкубировали совместно с аллореактивными Т-клетками в течение 4 дней. Т-клеточную пролиферацию измеряли на 5 день по включению [3H]-тимидина. Результаты показаны в ед./мин +/- СО по триплетным лункам. * Р>0.001 по сравнению с необработанными ДК (-).
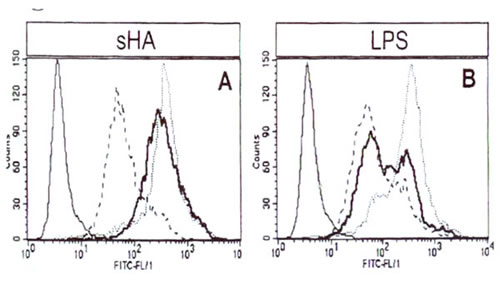
Иллюстрация 4. МГА-индуцированное созревание ДК не зависит от LPS ДК инкубировали с сГА (А) или LPS (Б) и анализировали экспрессию HLA-DR методом FACS. Тонкая сплошная линия показывает изотипный контроль, прерывистая линия показывает экспрессию HLA-DR на необработанных клетках, пунктирная линия показывает экспрессию HLA-DR на ДК, стимулированных мГА (А) или LPS (Б). Жирная линия: экспрессия HLA-DR на ДК, предварительно обработанных полимиксином Б.
Поскольку описано, что LPS в концентрации 50 пг/мл активирует клетки миело-моноцитной линии 22, мы решили исключить возможность того, что препараты мГА, использованные а наших экспериментах, содержали следовые количества LPS. Как показала проверка методом LAL, все вещества, использованные при получении мГА и культивировании ДК, не содержали эндотоксинов (данные не показаны). Кроме того, добавление 10 мкг/мл ингибитора LPS полимиксина Б не оказывало эффекта на мГА-индуцированное повышение уровня МНС II класса (Рис. 4А), В7-1, В7-2 или CD1a (данные не показаны), но в том же эксперименте ингибировало все эффекты LPS (Рис. 4Б). Из этих экспериментов следует вероятность того, что эффекты мГА на ДК имели место за счет присутствия LPS.
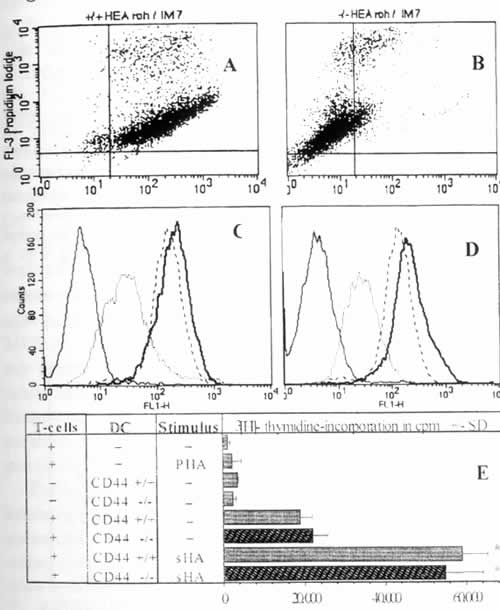
Иллюстрация 5. МГА вызывают CD44-независимое созревание ДК Мышиные ДК были получены из мышей C57BL/6 с отсутствием CD44 (Б, Г) и из мышей дикого типа (А, В) и стимулировались мГА или LPS в течение 48 часов или остались необработанными. (А, Б) Двойное окрашивание ДК с экспрессией CD44 по оси х и поглощением йодида пропидия по оси у. (В, Г) Уровень экспрессии Iab на ДК дикого типа или ДК CD44-/- : пунктирная линия – необработанные ДК; прерывистая линия – ДК, стимулированные LPS; жирная линия – ДК, обрапботанные мГА; сплошная линия – контрольные мАТ, подобранные по изотипу. (Д) ДК были предаврительно обработаны, как указано, и инкубировались в течение 5 дней с аллореактивными Т-клетками из мышей Balb/C, после чего измерили пролиферацию по включению [3H]-тимидина. Результаты показаны в ед./мин +/- СО по триплетным лункам. * Р>0.001 по сравнению с необработанными ДК (-).
Показано, что СD44 является главным клеточным ГА-рецептором 23,24. Это поднимает вопрос о том, вызывает ли CD44, который в большом количестве экспрессируется на ДК, мГА-индуцированное созревание ДК. Полные или f(ab)-фрагменты анти-CD44 моноклональных антител, для которых показана способность блокировать связывание ГА с человеческим CD44 24, являются неподходящим инструментом для этого, поскольку они индуцируют кластеризацию ДК и частичную активацию данные не указаны и 24. В качестве альтернативного подхода, мы исследовали ДК из мышей с отсутствием CD44. Для начала мы подтвердили, что мГА также индуцировали созревание мышиных ДК, полученных из костного мозга мышей C57BL/6 дикого типа. Это включало в себя повышенную экспрессию Iab, B7-1, B7-2, а также повышенную аллостимуляторную способность (Рис. 5В,Г,Д). Инкубация тех же мышиных ДК с СР-ГА или ВМ-ГА не имела эффекта (данные не показаны). Важно отметить, что мГА-индуцированное созревание также наблюдалось в ДК, полученных из мышей C57BL/6 с отсутствием CD44 (Рис. 5А,Б), что также проявлялось заметным повышением аллостимуляторной способности в сравнении с мГА-стимулированными ДК дикого типа (Рис. 5Д). Это показывает, что экспрессия CD44 не требуется для проявления эффектов мГА на этих ДК. Однако нельзя исключать возможность, что CD44 может участвовать в мГА-индуцированном созревании мышей CD44 дикого типа. Далее следует исключить, что эффекты мГА проявляются посредством второго ГА-рецептора RHAMM, поскольку мы не определяли мРНК RHAMM в зрелых или незрелых ДК методом ПЦР с использованием обратной транскриптазы (Рис. 6А) или экспрессию RHAMM на поверхности или в цитоплазме ДК методом FACS (Рис. 6Б).
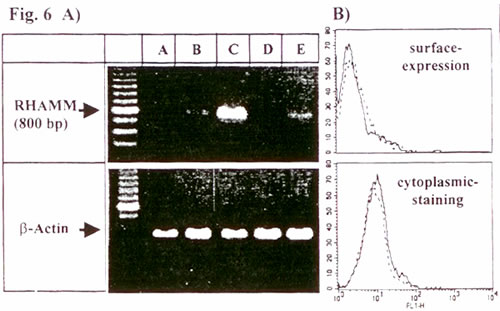
Иллюстрация 6. ДК не экспрессируют RHAMM
A) Общее количество РНК определяли методом ПЦР с использованием обратной транскриптазы из: А – необработанных ДК; Б – ДК, стимулированных LPS; B – RHAMM-положительной клеточной линии рака молочной железы T47D; Г – ДК, обработанных мГА; Д – ДК, обработанных ВМ-ГА.
Б) ДК были также исследованы методом FACS на предмет наличия экспрессии RHAMM (сплошные линии). Пунктирные линии показывают окрашивание контрольной сывороткой.
Таблица I. МГА-индуцированное созревание ДК является специфичным для ГА-олигосахаридов.
| Stimulus | 5>?g/ml | 10?g/ml | 20?g/ml | 50?g/ml | 100?g/ml | |||||
| HMW-HA | 5.3 | +/-0.6 | 3.6 | +/-0.9 | n.d. | n.d. | 6.9 | +/-1.5 | 2.6 | +/-0.7 |
| sHA | 5.7 | +/-1.6 | 563.6 | +/-45.8 | 1875.3 | +/-201.5 | 2174.8 | +/-182.2 | 2076.2 | +/-104.8 |
| - | 1.7 | +/-0.3 | --- | --- | --- | --- | --- | --- | --- | --- |
| LPS (10?g/ml) | 2234 | +/-145 | --- | --- | --- | --- | --- | --- | --- | --- |
| HS | n.d. | n.d. | 3.4 | +/-0.6 | cyt | cyt | cyt | cyt | cyt | cyt |
| Shs | n.d. | n.d. | 2.6 | +/-1.5 | cyt | cyt | cyt | cyt | cyt | cyt |
| CS-C | 4.7 | +/-1.6 | 6.3 | +/-2.6 | n.d. | n.d. | 1.8 | +/-0.6 | 3.8 | +/-2.6 |
| sCS-C | 8.4 | +/-3.2 | 2.4 | +/-0.4 | 3.1 | +/-1.7 | 4.8 | +/-1.1 | 8.3 | +/-3.7 |
| Glyceraldehyde | 6.6 | +/-0.7 | 6.2 | +/-1.0 | 4.4 | +/-1.0 | 2.6 | +/-0.5 | 0.5 | +/-0.1 |
| Glyoxal | 5.5 | +/-0.8 | 5.7 | +/-0.3 | 4.9 | +/-0.6 | cyt | cyt | cyt | cyt |
Человеческие ДК инкубировали в течение 24 часов с указанными веществами различных концентраций, 10 мкг/мл LPS, или оставили необработанными и бесклеточные надосадки исследовали на содержание TNF?. Результаты показаны в пг/мл TNF? +/- стандартное отклонение (СО). Цит.= цитотоксичный, н.о.= не определяется. Для того чтобы определить, влияют ли другие гликозаминогликаны (ГАГ), присутствующие в ВКМ, на созревание ДК, ДК были обработаны очищенным хондроитинсульфатом С (ХС-С) или гепарансульфатом (ГС) в виде целых молекул или после ферментативного расщепления до размера олигосахаридов (сХС-С, сГС). Хотя ХС и ГС демонстрируют высокий уровень структурной гомологии с ГА, будучи составленными из повторяющихся дисахаридных единиц, они не влияли на синтез TNF? в ДК или повышение уровня МНС II класса и молекул В7-1 и В7-2 (Таблица I и данные не показаны). Чтобы исключить, что высокие концентрации реактивных альдегидных групп, присутствующих на свободном N-ацетил-гликозаминном конце, ответственны за созревание ДК, мы проверили действие двух малых альдегидов глиоксаля и глицеральдегида. Однако эти вещества не вызывали созревание ДК в концентрациях, используемых для мГА (5-50 мкг/мл) (Таблица I).
Обсуждение
В данной работе мы показали, что только малые ГА-фрагменты размером в 4-16 олигосахаридов, но не фрагменты среднего размера (СР-ГА) или высокой молекулярной массы (ВМ-ГА) вызывают окончательное и необратимое созревание человеческих и мышиных дендритных клеток. Это согласуется с исследованиями в области воспаления и заживления ран 26-32. МГА-фрагменты размером в 3-10 олигосахаридов ускоряли неоангиогенез во время заживления раны в течение 48-72 часов 27. В соответствии с нашими результатами, ВМ-ГА не влияет на ангиогенез, а при высоких концентрациях даже проявляет антиангиогенное действие 27. Кроме того, способность мГА, но не ВМ-ГА, непосредственно стимулировать рост и формирование трубок эндотелиальными клетками была продемонстрирована на нескольких моделях, включая хориоаллантоические мембраны цыпленка, кожу крысы и мышиные кожные трансплантанты 27-29. К тому же, мГА-фрагменты размером в 10-16 олигосахаридов не оказывали действия на пролиферацию эндотелиальных клеток 27, таким образом подтверждая наши выводы о том, что только мГА-фрагменты размером в 4-16, но не 10-16 олигосахаридов, активируют ДК.
С другой стороны, описано, что как фрагменты СР-ГА с пиковой молекулярной массой 200 кДа, так и мГА длиной в 6 олигосахаридов активируют мышиные альвеолярные макрофаги посредством Nf?B/I?B пути 30. Кроме того, показано, что они повышают синтез мРНК и белковую секрецию хемокинов MIP-1?, MIP-1? и МСР-1 31, а также индуцируют активность NO-синтазы (iNOS) 32. Это частично противоречит нашему выводу о том, что СР-ГА (мол. масса 80-200 кДа) не оказывает действия на ДК. Несоответствие результатов может быть связано с различными типами клеток, использованными в экспериментах, то есть мышиные альвеолярные макрофаги 30-32 и человеческие или мышиные дендритные клетки (в нашей работе). С другой стороны, это может быть обусловлено методом получения СР-ГА, использованным МакКи и др., который не исключает возможности содержания в препаратах значительных количеств мГА-фрагментов 30-32.
Нашей следующей задачей было определить, зависит ли мГА-индуцированное созревание ДК от известных ГА-рецепторов CD44 и RHAMM 16,23-24. Важно отметить, что мГА-ответ ДК, полученных из мышей с отсутствием CD44, был идентичен ответу ДК, полученных из мышей с CD44. Это показывает, что действие мГА не зависит от СD44. Подобные заключения были сделаны при исследовании мГА-стимулированной пролиферации сосудистых эндотелиальных клеток 27-29. Перинуклеарное окрашивание на CD44 эндотелиальных клеток, обработанных мГА, не отличалось от необработанных клеток 28, показывая, что поглощение мГА и специфическая Nf?B-зависимая сигнализация не обусловлена CD44. Представление о том, что мГА-фрагменты взаимодействуют с клетками независимо от CD44 подтверждается недавно полученными данными Калти и др. и Тэмми и др. 23,33. Основываясь на исследованиях ВМ-ГА, эти исследователи сделали вывод о том, что только мГА-фрагменты длиной не менее 6-10 олигосахаридов связываются с CD44 на эндотелиальных клетках или кератиноцитах, соответственно. Кроме того, мы не нашли подтверждения тому, что RHAMM участвует в мГА-индуцированном созревании ДК, поскольку ни мРНК, ни белок RHAMM не были обнаружены в человеческих ДК.
Заключение
Мы показали, что только малые ГА-фрагменты размером в 4-16 олигосахаридов, но не большие СР-ГА или ВМ-ГА, вызывают необратимое фенотипическое и функциональное созревание ДК. Это действие высоко специфично для гиалуронана и не наблюдалось после стимуляции ДК другими ВКМ-гликозаминогликанами, такими как хондроитинсульфат С или гепарансульфат. Эти данные позволяют предположить, что мГА-фрагменты, образующиеся в участках воспаления, in vivo активируют ДК, мигрирующие внутрь или из этих тканей, стимулируя и поддерживая таким образом иммунный ответ.
Благодарности
Мы признательны Др.Р. Шмиттсу, Гомбургский Университет, Гомбург, Германия, за предоставленных им CD44 -/- мышей.