Абстракт
Небольшая химическая модификация гиалуроновой кислоты (ГА) позволяет получить функциональные производные для разработки систем направленной доставки лекарств, перевязочных материалов, матрикса для тканевой инженерии и детекторов клеточного связывания и транспорта ГА. В первой части описывается использование ковалентных ГА-противораковых агентов в качестве потенциальных терапевтических средств. Противораковую стратегию подтверждают данные по клеточным культурам, проточной цитометрии и мышиным моделям in vivo. Во второй части описываются новые гибкие гидрогелевые пленки, состоящие из хондроитинсульфата (ХС), связанного с ГА, которые потенциально могут быть использованы в качестве перевязочных материалов, способных к биоинтеграции и доставке лекарственных препаратов. В результате лиофилизации и регидратации этих гибких пленок получаются пористые материалы для клеточного роста и тканевой инженерии. В третьей части описываются результаты определения структуры ГА-связывающего домена (ГАСД) белка РГАММ и использование этого домена для определения пептидомиметиков ГА.
Ключевые слова
Гиалуроновая кислота, биосовместимый, противораковый, целевой, биоконъюгат, связывание, гидрогель, биоразлагаемый, высвобождение лекарства, заживление ран
Введение
Гиалуронан (гиалуроновая кислота, ГА) in vivo выполняет важную двойственную роль. В качестве основного материала он принимает участие в поддержании гомеостаза, смазывании суставов и играет роль главного вязко-эластичного компонента внеклеточного матрикса (ВКМ). В качестве сигнальной молекулы, ГА специфично связывается с белками в ВКМ, на поверхности клетки и в клеточном цитозоле, таким образом участвуя в стабилизации хрящевого матрикса, клеточной подвижности, действии факторов роста, морфогенезе и эмбриональном развитии и в воспалении. Наше исследование преследует две цели. Во-первых, мы приводим два примера использования химически модифицированного ГА в качестве строительного материала для биосовместимых и биоразлагаемых полимеров, могущих получить применение в доставке лекарств, тканевой инженерии и в качестве вязкой добавки. Во-вторых, мы представляем подходы к изучению структуры и функции комплексов ГА-белок.
ГА также играет важную роль в заживлении ран. ГА-насыщенный матрикс способствует инфильтрации мигрирующих клеток в поврежденную ткань и обеспечивает среду, благоприятную для клеточной подвижности и пролиферации. Продукты распада ГА модулируют воспалительный ответ и стимулируют ангиогенез. Кроме того, ГА выступает в качестве сигнальной молекулы для обеспечения клеточной подвижности, воспаления и заживления ран. Таким образом, перевязочный материал с подобными свойствами мог бы оказаться важным фактором быстрой стабилизации состояния пациентов с ожогами. Ранее были описаны сложные составные материалы, содержащие ГА, использующие ГА и химически модифицированный ГА в доставке лекарств и ковалентно связывающие ГА с пластиковыми поверхностями. В данной работе представлены примеры применения ГА, модифицированного адипиновым дигидразидом (АДГ), для целевой доставки противораковых лекарств и для получения клеточно-совместимых связанных гидрогелей.
Иллюстрация 1. Превращение ГА-АДГ в биоматериалы и биодетекторы
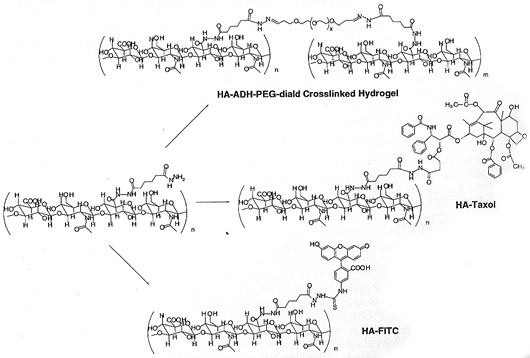
Материалы и методы
Получение и описание гидрогелевых пленок на основе ГА-таксола и ГА-ПЭГ
Мы модифицировали ранее опубликованные методы для более эффективного контроля модификации и для получения гомогенного ГА-АДГ. Степень чистоты ГА-АДГ после диализа определили с помощью гель-проникающей хроматографии (ГПХ); степень модификации глюкуронатом (от 2% до 55%) определили с помощью 1H-ЯМР. ГА-таксол получили путем связывания активированного эфира таксола 2-гемисукцинната, после чего получили ГА-FITC-таксол путем взаимодействия ГА-АДГ с 5 моль% FITC и последующего связывания с активированным производным таксола. Продукты были повторны очищены с помощью диализа, степень чистоты установили с помощью ГПХ, ЯМР и УФ.
Связывание ГА-АДГ также модифицировали поли(этиленгликоль)-пропиондиальдегидом (ПЭГ-диальдом) для получения бис-гидразонового гидрогеля с механическим свойствами, подобными свойствам эпидермиса. Гидрогель образовался в течение 60 сек после смешивания растворов ГА-АДГ и ПЭГ-диальда; после испарения растворителя получили гибкую ГА-гидрогелевую пленку.
Определение поглощения ГА-таксола и клеточной токсичности
Для исследования поглощения флуоресцентно-меченого ГА и токсичности использовали четыре линии человеческих раковых клеток (SK-OV-3, HBL-100, HCT-116 и MDA-231) и контрольные клетки (мышиные фибробласты NIH 3T3). Цитотоксичность определяли с помощью 96-луночного планшета в четырех повторностях с повышающимися дозами на 20,000 клеток в 200 мкл культуральной среды в каждой лунке. Конъюгаты ГА-таксол добавляли из раствора ДМСО : вода = 1:1, о/о; свободный таксол добавляли в виде раствора в ДМСО. Клетки инкубировали при 37?С в течение 3 дней с исследуемым веществом, количество живых клеток определяли по поглощению красителя МТТ при 540 нм. Результат представили в качестве процентного содержания живых клеток по отношению к контрольным лункам.
Заживление ран при применении ГА-гидрогелевой пленки на мышиной модели
На экспериментальной мышиной модели сделали ранения диаметром 1 см на спинной части мышей линии Balb/c, при этом удалили эпидермальный и дермальный слои кожи. Раны перевязывали материалами Biobrane® или Tegaderm® (в качестве контрольных) либо ГА-гидрогелевыми пленками, стерилизованными оксидом этилена, с последующим перевязыванием Biobrane® или Tegaderm®. Спустя 5 дней мышей умертвили, участки ранений вырезали и провели гистологический анализ образцов тканей. Необходимые интервалы времени для заживления ран составили, по данным биопсии, 3, 5, 7 и 10 дней.
Суб-клонирование, экспрессия и очистка ГА-связывающего домена RHAMM
Для получения конструкции РГАММ (518-580)-GST в pGEX-2Т (Pharmacia) с использованием уникальных рестрикционных сайтов EcoR1 и BamH1 применяли кДНК ГА-связывающего домена (ГАСД) РГАММ v4 (Рецептор для ГА-индуцированной клеточной подвижности). GST-РГАММ (518-580) (R D S Y A Q L L G H Q N L K Q K I K H V V K L K D E N S Q L K S E V S K L R S Q L V K R K Q N E L R L Q G E L D K A L G I R), содержащий два мотива ВХ7В (подчеркнуты) экспрессировали в клетках E.coli BL21 в ампициллин-содержащей среде путем индукции ИПТГ. Клетки собрали, разрушили и очистили белок, слитный с GST, на колонке с GSH-сефарозой при 4?С путем элюции в буфере, содержащем 50 мМ глутатион и 10 мМ Tris, рН 8.0.
Результаты и обсуждение
Селективное клеточное поглощение и цитотоксичность ГА-таксола
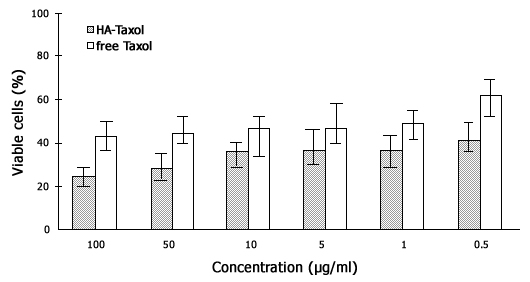
Клеточно-направленное полимерное пролекарство, полученное из таксола и химически модифицированного ГА было исследовано in vitro. Мы обнаружили шесть способов подтверждения селективного поглощения и направленной токсичности ГА-связанных пролекарств. Во-первых, был получен флуоресцентно-меченый ГА с тремя различными флуорофорами (Texas Red, FITC и BODIPY) и с ГА двух размеров (12 кДа и 200 кДа). И лазерная конфокальная микроскопия, и флуоресцентно-активируемая клеточная сортировка подтвердили поглощение ГА-флуорофоров клетками, экспрессирующими рецепторы ГА. В клетках, у которых эти рецепторы отсутствовали, не происходило интернализации ГА-флуорофоров. Кроме того, скорость поглощения зависела от размера ГА: ГА размером 12 кДа полностью поглощался в течение 30 минут, тогда как ГА размером 200 кДа требовалось от 8 до 24 часов для полного поглощения.
Во-вторых, мы синтезировали флуоресцентно-модифицированный ГА-таксол (FITC-ГА-таксол) и использовали его для демонстрации клеточно-специфичного связывания и поглощения с помощью проточной цитометрии и конфокальной микроскопии. В-третьих, селективная цитотоксичность FITC-ГА-таксола позволила напрямую скоррелировать ее с поглощением. В четвертых, быстрое поглощение и селективная цитотоксичность биоконъюгатов ГА-таксол могли быть заблокированы либо избыточным ГА, либо анти-CD44 антителами, но не ХС. В пятых, высвобождение свободного таксола из конъюгата ГА-таксол в человеческой плазме или в культуральной среде показало, что лекарство в свободном виде высвобождалось из конъюгата гидролитически путем расщепления лабильной 2'-эфирной связи. Вместе все вышеперечисленные результаты подтверждают, что направленная цитотоксичность биоконъюгатов ГА-таксол требует рецептор-индуцированного клеточного поглощения биоконъюгата с последующим гиролитическим высвобождением свободного таксола. В итоге, добавление фрагментов ГА размером 12 кДа к лизосом-направленному поли(НРМА)-адриамициновому аддукту (в настоящий момент находящемуся во II фазе клинических испытаний) повысило селективную цитотоксичность этого полимерного пролекарства по отношению к раковым клеткам от 10 до 20 раз (Ю.Луо, Дж. Копецек, Дж.Д. Прествич, из неопубликованного). В настоящее время ведутся исследования на мышиных моделях человеческих опухолей для подтверждения результатов, полученных на клетках.
Иллюстрация 2. Токсичность ГА-таксола в линии клеток НСТ-116.
Получение гибкого биосовместимого ГА-гидрогеля для заживления ран и высвобождения лекарств
Новый ГА-гидрогель был получен в нейтральных водных условиях с применением макромолекулярного связывателя. Этот новый биосовместимый материал застывает в течение нескольких минут и после испарения растворителя, в течение нескольких секунд набухает, превращаясь из гибкой сухой пленки в гибкий пористый гидрогель. Эта новая быстро застывающая и быстро набухающая гидрогелевая пленка, возможно, станет более приемлемым биоматериалом, чем ранее предложенные ГА-гидрогели. Химия реакции связывания включает быстрое образование гидразона при значениях рН от кислых до щелочных. Образованный таким способом гидрогель может быть использован напрямую практически в любой биологической системе, поскольку и сам гидрогель, и два его макромолекулярных составляющих являются биосовместимыми и биоразлагаемыми. Он отличается значительными преимуществами при нагрузке лекарственными препаратами по сравнению с ранее предложенными ГА-гидрогелями, поскольку при его получении не требуется щелочных условий, высоких температур и малых потенциально токсичных молекул-связывателей. Использование этого материала для доставки лекарств описывается в литературе. Важно отметить, что подобные способы АДГ-модификации и связывания с ПЭГ-диальдом применимы и к полиакриловой кислоте, альгиновой кислоте, пектину и сульфатированным гликозаминогликанам; таким образом, при исследовании широкого спектра механических и химических свойств могут быть подобраны гидрогели с оптимальными характеристиками для специфического медицинского применения.
В литературе показано, что тканево-совместимые гидрогели способны обеспечивать естественную гидрофильную среду для контролируемой доставки лекарств, причем скорость высвобождения лекарств можно регулировать, контролируя набухания геля и плотность связывания. Были получены разнообразные ГА-гидрогели с бисэпоксидами, такими как диэпоксибутан и диглицидиловый эфир этиленгликоля, в сильно щелочных условиях с этанолом в качестве со-растворителя. С помощью этих методов связывания были получены ГА-гидрогелевые пленки с содержанием воды не более 60%. Гилановые гидрогели были получены с помощью обработки ГА, содержащего следы белков (частично очищенный экстракт петушиного гребня), формальдегидом до образования растворимого геля. Другие связыватели, например, дивинил сульфон, позволяли получить бесконечные молекулярные сети. Для связывания ГА использовались разнообразные бискарбодиимиды, в результате чего были получены гидрогели, содержащие бис-N-ацилмочевинные связи. При модификации бифункциональными гидразидами или полигидразидными связывателями также были получены связанные гидрогели.
Раньше получение ГА-производных материалов с достаточной упругостью для применения в условиях биомеханического напряжения было проблематичным. ГА-производные с наилучшими механическими характеристиками получали в сильнощелочных условиях и при повышенных температурах, препятствующих включению чувствительных молекул или живых клеток при приготовлении полимерной сети гидрогеля. Кроме того, такие реакции протекали при участии малых молекул-связывателей, зачастую применяемых в больших количествах, которые требовали значительной очистки для физиологического применения. Результаты с нашим новыми связанными ГА- и ХС-гидрогелевыми пленками являются стимулом к дальнейшему изучению их применения в заживлении ран и предотвращении послехирургических осложнений.
Определение степени ре-эпителизации в мышиной модели
В ранениях, покрытых гидрогелевыми пленками, наблюдалось улучшение заживления ран путем ре-эпителизации по сравнению с ранениями, покрытыми другим коммерчески доступным перевязочным материалом, Biobrane®. Гистологическое исследование образцов биопсии ткани в контрольной группе продемонстрировало большую незаживленную область повреждения (Рис. 3а), практически не имеющую эпидермиального покрытия на поверхности ранения. Увеличение (10 х) позволяет увидеть заживающий край поврежденного участка. При покрытии ранения ГА- (либо ХС-) гидрогелевыми пленками с последующим покрытием материалом Biobrane® наблюдалось улучшение ре-эпителизации. Область незаживленного повреждения значительно уменьшена по сравнению с контрольной группой (Рис. 3б). На увеличенном изображении виден новый, толщиной в несколько клеток, слой эпидермального роста, покрывающий область повреждения. Кроме того, под слоем нового эпидермиса образуется новая дермальная ткань.
Иллюстрация 3. Гистологический анализ образцов ткани из участков повреждения, покрытых Biobrane® (панель а) и ГА-гидрогелевой пленкой (панель б) (1 деление шкалы = 1 мм).

Структура ГАСД РГАММ и идентификация пептидов, связывающихся с РГАММ
Вторичная структура РГАММ, важного медиатора клеточной трансформации и передачи сигнала, а также клеточной подвижности, предположительно состоит из спиральных элементов. Действительно, недавно методом многомерного ЯМР была определена структура ГАСД: при разрешении 3 ? обнаружено, что она представляет из себя спираль-петлю-спираль с третичной структурой двойной спирали (в отличие от связующего модуля белков TSG-6 и CD44, в которых преобладающей является вторичная ?-слоистая структура). Используя нумерацию мышиного РГАММ, N-конец ГАСД полностью погружен в петлю (остатки 531-539), тогда как вторая половина домена (остатки 553-562) охватывает петлю и спиральную часть. Для взаимодействия ГА с ГА-связывающими белками требуется электростатическое взаимодействие между карбоксилатами глюкуроната и основными остатками ГАСД, а также гидрофобные взаимодействия, включающие С-Н-богатые области на ГА.
Мы провели скрининг двух мономерных однопептидных библиотек октамеров и фаговой библиотеки 15-меров с помощью ГАСД РГАММ для того, чтобы определить высокоаффинные пептиды, способные связываться с ГАСД. Одна из пептидных библиотек представляла из себя смещенную библиотеку с переменными кислыми аминокислотами, разработанными в качестве миметиков природных переменных карбоксилатов глюкуроновой кислоты в ГА. Это один из первых подходов рационального дизайна лекарств для определения не-ГАГ лиганда для ГА-связывающего сайта. Удачное определение подобных пептидных лигандов позволит селективно воздействовать на различные рецепторы ГА. Кроме того, смещенная библиотека включает как природные, так и искусственные конфигурации кислых остатков для дальнейшего исследования возможных конформаций олигосахаридов, которые могут играть важную роль в узнавании лиганда.
Мы получили четыре основных результата. Во-первых, как в смещенных, так и в рандомизированных библиотеках были определены повторяющие пептидные мотивы, связывающиеся с ГАСД. Эти дипептидные и трипептидные мотивы обнаруживались как в рандомизированных фаговых, так и в смещенных мономерных библиотеках. Во-вторых, были разработаны два метода количественной оценки относительной аффинности и селективности взаимодействий пептид - РГАММ. Селективность пептидных лигандов по отношению к ГАСД была установлена по: 1) определению связывания биотин- и флуоресцеин-меченых пептидов с иммобилизованными белками, и 2) флуоресцентной поляризации FITC-меченых пептидов с ГАСД в растворе. ГА конкурентно замещал связывание пептидов с ГАСД, тогда как другие гликозаминогликаны были менее эффективны. В-третьих, была показана важность включения кислых аминокислотных остатков в искусственные конфигурации. Была определена абсолютная стереохимия трех наиболее аффинных смещенных октапептидов методами синтеза и связывания с 16 стереоизомерами каждого пептида. Наблюдалось строгое предпочтение переменным D- и L-конфигурациям для кислых остатков, что соответствовало предсказанной ориентации участков ГА с глюкуроновой кислотой. Наконец, в клетках опухоли молочной железы MDA-MB-231 с чрезмерной экспрессией РГАММ наблюдалось связывание и интерналзация флуоресцентных ГА-мимикрирующих пептидов, причем это поглощение предотвращалось предварительной инкубацией клеток с ГА. Это позволяет предположить, возможность разработки не-гликозаминогликановых лигандов, специфичных для данного рецептора ГА, для целевой доставки лекарств к данной клеточной популяции. На основе наших данных могут быть разработаны новые области применения ГА-мимикрирующих пептидов в базовой клеточной биологии и в разработке новых терапевтических средств.
Выводы
ГА, ковалентно модифицированный гидразидами, может связываться с терапевтическими агентами для получения систем целевой доставки лекарств. Была показана опухоле-специфичная токсичность аддукта ГА-таксол. Кроме того, показана возможность связывания ГА для получения гидрогелевых пленок, применимых для доставки лекарств, культивации клеток или тканевой инженерии. Использование макромолекулярного бисальдегидного связывателя позволило получить пленку, которая ускоряла ре-эпителизацию при заживлении ран. Высвобождение лекарств из нового материала in vitro продемонстрировало возможность высвобождения анти-инфекционных или анальгезирующих препаратов в участках повреждений. И, наконец, была определена структура ГАСД РГАММ, показавшая наличие ?-спирального элемента узнавания ГА, отличного от элемента ?-слоя в связывающем белке. ГАСД РГАММ был использован для отбора пептидов из рандомизированных и смещенных библиотек с наномолярной эффективностью связывания, специфичной для данного ГАСД.