Абстракт
Повышение содержания гиалуронана (ГА) в бронхоальвеолярной омывающей жидкости легких человека происходит при многих патологических состояниях, при которых наблюдается воспаление легких, включая астму и хроническую непроходимость дыхательных путей (ХНДП). Считается, что компонент клеточной стенки грамотрицательных бактерий, липополисахарид (ЛПС), является важным фактором в патогенезе этих легочных заболеваний. Целью нашей работы было изучение местного действия ЛПС на накопление гиалуронана в легких. Для этого самцам швейцарских мышей закапывали 5 мкг ЛПС внутритрахеально (ВТ) и исследовали в разные промежутки времени после воздействия ЛПС. Контрольным мышам либо закапывали физиологический раствор, либо не закапывали ничего. Приток нейтрофилов в легкие считали признаком острого воспаления. Содержание ГА определяли методом гистолокализации с использованием биотинилированного ГА-связывающего белка (б-ГАСБ). Полученные данные свидетельствуют о том, что ВТ-закапывание ЛПС вызывает интенсивное воспаление легких, на которое указывает быстрое увеличение количества нейтрофилов, достигающее максимального значения спустя 24 часа после закапывания. Гистолокализация ГА выявила интенсивное окрашивание ГА в промежуточной ткани дыхательных путей и крупных сосудов контрольных мышей. В легких мышей, которым закапывали ЛПС, наблюдалось накопление ГА вокруг мелких сосудов капиллярной выстилки и в субплевральной области спустя 24 и 72 часа после закапывания ЛПС, особенно в участках инфильтрации лейкоцитов. Поскольку считается, что регуляция содержания ГА на эндотелии играет роль в притоке лейкоцитов в местах воспаления, накопление ГА в капиллярной выстилке, возможно, вносит вклад в развитие ЛПС-индуцированного воспаления легких.
Ключевые слова
Гиалуронан, воспаление, липополисахарид, легочное заболевание.
Введение
Гликозаминогликан внеклеточного матрикса гиалуронан (ГА) в норме является составляющим свободной соединительной ткани легких. Повышение содержания ГА в бронхоальвеолярной омывающей жидкости легких человека происходит при многих патологических состояниях, при которых наблюдается воспаление легких, включая астму, синдром дыхательной недостаточности взрослых (СДНВ), альвеолит и хроническую непроходимость дыхательных путей (ХНДП). Считается, что липополисахарид (ЛПС), главный гликолипидный компонент клеточной стенки Грам-отрицательных бактерий, является важным фактором в патогенезе этих легочных заболеваний. При длительном воздействии взвешенных в воздухе частиц, содержащих бактерии и ЛПС, в дыхательной системе в норме происходит активизация защитных механизмов против этих агентов. Однако при длительном воздействии пыли, содержащей ЛПС, например, на работников зерновых складов или фермеров, занимающихся разведением свиней, развивается воспаление легких, сопровождающееся респираторными симптомами и вызывающее различные легочные заболевания.
Результаты исследований in vitro показали, что ЛПС способен вызывать продукцию ГА в различных типах клеток, включая легочные фибробласты и эндотелиальные клетки капиллярной выстилки. Целью настоящей работы было исследование локального воздействия ЛПС на накопление ГА в легких in vivo. Для этого мы использовали мышиную модель острого воспаления легких, вызванного однократным внутритрахеальным закапыванием ЛПС. Приток нейтрофилов в легкие считали признаком острого воспаления. Содержание ГА определяли методом гистолокализации с использованием белка, связывающего биотинилированный ГА (б-ГАСБ).
Материалы и методы
Экспериментальный протокол
Самцы швейцарских мышей (30-40 г) были приобретены в Charles River Breeding Laboratories (Гейдельберг, ФРГ). Животных держали отдельно в стандартных лабораторных клетках и предоставляли пищу и питье без ограничения на протяжении всех опытов, которые проводили по протоколу, принятому Учредительным комитетом по защите животных Университета Маастрихта, Нидерланды.
Мышам закапывали препарат внутритрахеально (ВТ) нехирургическим способом. Для изучения распределения раствора в легком закапывали бромотимоловый синий, растворенный в 50 мкл 0.9% NaCl. Макроскопический и микроскопический анализы показали, что синий индикаторный краситель распределился по всему легкому. Мышей (n = 6 в каждой группе) обезболили внутрибрюшным введением 3 мг/кг ксилазина и 75 мг/кг кетамина (Nimatek, AUV Cuijk, Нидерланды). 5 мкг ЛПС (Escherichia coli, серотип О55:В5, Sigma, St. Louis, MO), растворенного в 50 мкл стерильного 0.9% NaCl, закапывали ВТ через канюлю, после чего вводили 0.15 мл воздуха. Имитационным мышам закапывали ВТ 50 мкл стерильного 0.9% NaCl без ЛПС, контрольным мышам не закапывали ничего. После ВТ закапывания мышей держали вертикально в течение 10 минут для распределения жидкости в легких. Мышей убивали спустя 4, 8, 24 либо 72 часа после закапывания. После торакотомии легкие подготавливали для изучения методом световой микроскопии и миелопероксидазного анализа.
Гистология
В левое легкое закачивали 10% раствор формалина в фосфатном буфере (рН 7.4) под давлением 20 см Н2О через трахею в течение 15 минут, после чего фиксировали в формалине в течение 24 часов. После заключения в парафин нарезали на срезы толщиной 4 мкм и окрасили гематоксилином и эозином (ГЭ) для гистологического анализа.
Определение активности миелопероксидазы
Миелопероксидазу выделили из быстрозамороженной ткани правого легкого, как описано ранее. Ферментативное определение МПО проводили на 96-луночном планшете (Greiner, Нуртинген, ФРГ) по методу Демена и др. Вкратце, реакционные смеси состояли из 40 мкл 0.75 мМ Н2О2 в 80 мМ PBS (pH 5.4) и 40 мкл образца, растворенного в 50 мМ PBS (рН 6.0), 0.5% бромида гекса-1,6-бис-децилтриметиламмония (Sigma). Реакцию запусткали добавлением 20 мкл 8 мМ 3,3',5,5'-тетраметилбензидина (ТМБ; Boeringer Mannheim, Манхейм, ФРГ) в диметилсульфоксиде (Sigma) и останавливали спустя 15 минут добавлением 100 мкл 1 М Н2SO4 в лунку. После этого определяли оптическую плотность при 450 нм. Все реакции проводили в триплетах. Активность МПО рассчитывали на мг легочной ткани и вносили поправку в расчете на соотношения сырой массы к сухой массе. Для вычисления активности МПО, выражаемой в единицах активности (среднее значение ± с.о.), использовали титрационную кривую пероксидазы хрена. Статистический анализ проводили по U-тесту Манна-Уитни, значения вероятности ниже 0.05 считались статистически значимыми.
Гистолокализация ГА
Гистолокализацию ГА проводили в парафиновых срезах с использованием биотинилированного ГАСБ из бычьего носового хряща, любезно предоставленного Дж. Мелроузом (Сиднейский Университет, Австралия). Срезы подвергли депарафинизации и последующей регидратации. Срезы окрашивали б-ГАСБ (50 мкг/мл) при 4?С в течение 24 часов. После отмывки применили систему Vectastain авидин:биотинилированный пероксидазный комплекс (Vector, Burlingame, CA). Ферментативную реакционную способность проявляли с помощью 3-амино-9-этилкарбазола. Срезы слегка перекрасили гематоксилином и заключили в фарамаунт (DAKO, Глоструп, Дания). В срезах, предварительно обработанных 50 ед./мл гиалуронидазы из стрептомицетов (Calbiochem, San-Diego, CA) в течение 2 часов, не обнаружили значительного окрашивания, что свидетельствует о специфичности реакции окрашивания ГАСБ для ГА.
Результаты и обсуждение
ВТ закапывание ЛПС мышам вызывает острое воспаление легких
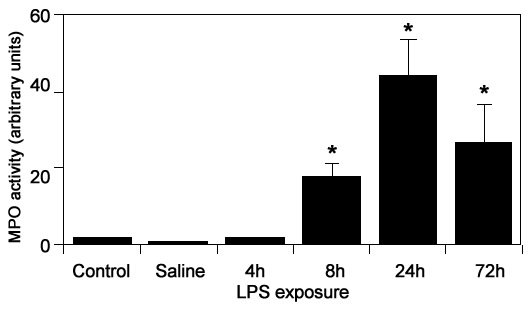
Анализ общих признаков воспаления в парафиновых срезах, окрашенных на ГА, показал, что ВТ закапывание ЛПС вызывает временное воспаление легких. В альвеолярной области наблюдался значительный приток нейтрофилов, зависимый от времени. Присутствие нейтрофилов в альвеолярных пространствах определялось начиная с 8 часов после закапывания ЛПС и достигало максимального значения через 24 часа (данные не показаны). Активность МПО в легочных гомогенатах измеряли для количественной оценки относительного накопления нейтрофилов в легком (Рис. 1). В соответствии с нашими гистологическими наблюдениями, активность МПО не определялась в легочных гомогенатах мышей спустя 4 часа после закапывания ЛПС и росла до значений в 17, 44 и 26 единиц спустя 8, 24 и 72 часа после закапывания ЛПС, соответственно. Активность МПО отсутствовала в легочной ткани имитационных и контрольных мышей. Спустя 24 и 72 часа после закапывания ЛПС наблюдался приток макрофагов и лимфоцитов в легочную ткань. Вместе взятые, полученные результаты свидетельствуют о том, что ВТ закапывание ЛПС вызывает временное воспаление легких, признаком которого является значительное накопление нейтрофилов, достигающее максимального значения спустя 24 часа после закапывания.
Иллюстрация 1. Количественная оценка притока нейтрофилов в легкие после ВТ закапывания ЛПС. Активность МПО определяли в легочных гомогенатах и выражали в единицах активности (среднее значение ? с.о.) * Р<0.05 против физиологического раствора (по U-тесту Манна-Уитни).
Зависимое от времени накопление ГА после ВТ закапывания ЛПС
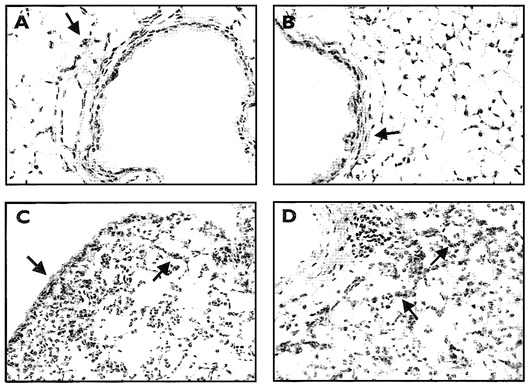
Недавние исследования in vitro показали, что стимуляция эндотелиальных клеток ЛПС приводит к увеличению продукции ГА от 4 до 72 часов после обработки ЛПС. Чтобы определить, вызывает ли обработка ЛПС in vivo повышенное накопление ГА в легких, мы оценивали накопление ГА в легочной ткани в разные отрезки времени после обработки ЛПС методом гистолокализации с использованием б-ГАСБ. Как показано на Рис. 2, ГА постоянно синтезируется в промежуточной ткани дыхательных путей и крупных сосудов контрольных мышей и мышей, которым закапывали ЛПС. Кроме того, в легких мышей, которым закапывали ЛПС, наблюдалось накопление ГА вокруг мелких сосудов капиллярной выстилки и в субплевральной области спустя 24 часа после закапывания, особенно в местах притока лейкоцитов. Дальнейшее повышение накопления ГА наблюдалось спустя 72 часа. Поскольку повышение содержания ГА на эндотелии предположительно играет роль в проникновении лейкоцитов к месту воспаления путем взаимодействия ГА с его первичным рецептором CD44, наши результаты позволяют предположить, что накопление ГА в капиллярной выстилке после закапывания ЛПС в легкие in vivo вносит вклад в наблюдаемый процесс воспаления легких.
Иллюстрация 2. Гистолокализация ГА в легочной ткани с использованием б-ГАСБ. А – контрольные мыши. В – мыши, которым вводили физиологический раствор, 24 часа. С – мыши, которым вводили ЛПС, 24 часа. D - мыши, которым вводили ЛПС, 72 часа. Изначальное увеличение 200х. Накопление ГА в субплевральной области и вокруг мелких сосудов капиллярной выстилки показано стрелками.
Заключение
В данной работе мы показали, что ВТ закапывание ЛПС приводит к острому воспалению легких, признаком которого является зависимое от времени накопление нейтрофилов в легочной ткани. Гистолокализация ГА выявила значительное окрашивание ГА в промежуточной ткани дыхательных путей и крупных сосудов как у контрольных мышей, так и у мышей, которым закапывали ЛПС. Местная обработка ЛПС вызывает повышенное накопление ГА в субплевральной области и вокруг мелких сосудов капиллярной выстилки спустя 24 и 72 часа, особенно в местах притока лейкоцитов.