Абстракт
В здоровой почке гиалуронан (ГА) присутствует в высокой концентрации в промежуточной мозговой ткани и в очень низкой концентрации в коре. Используя модельных крыс, мы исследовали регуляцию синтеза и распада ГА вдоль кортико-медуллярной оси почки. Кроме того, мы клонировали кДНК крысиной гиалуронидазы Hyal-2 и экспрессировали ее в клетках насекомых Sf9, после чего протестировали провоспалительные свойства ГА-фрагментов, полученных с помощью Hyal-2, с помощью биопробы in vitro на макрофагах.
Во внутреннем мозговом слое метаболизм ГА оказался связанным с процессами концентрирования и разбавления мочи. У крыс с высоким потреблением жидкости понизилась активность гиалуронидазы в мозговом слое и повысилась НА-синтазная активность, в результате чего тканевая концентрация ГА увеличилась в 2 раза. Средняя молекулярная масса ГА в мозговом слое составила > 4х106 Да и не зависела от изменений в потреблении воды.
В коре обнаружено накопление ГА меньшей молекулярной массы, в результате чего появлялись промежуточно-тканевые отеки при ишемическо-реперфузионных повреждениях и восстановлении после нефротоксического поражения, но не при почечной гипертрофии, вызванной унинефрэктомией. Как показали данные конкурирующей полимеразной цепной реакции (ПЦР) с использованием обратной транскриптазы, для пост-ишемических и токсических повреждений, но не для изменений в потреблении воды, характерно повышение уровня мРНК транскриптов Hyal-2 в коре. Эксперименты in vitro показали, что с помощью Hyal-2 образуются ГА-фрагменты как среднего размера, так и меньших молекулярных масс, которые способны активировать продукцию NO макрофагами.
Таким образом, мы показали на четко определенных почечных моделях задержки воды и воспаления, что модуляция ферментов, расщепляющих ГА, является частью механизма регуляции количества и воспалительных свойств ГА в физиологической и патологической тканях.
Ключевые слова
Гиалуроновая кислота, гиалуронидаза, обезвоживание, водная нагрузка, ишемия, воспаление, почечное повреждение, нефротоксины, клетки Sf9.
Введение
Гликозаминогликан гиалуронан (ГА) является высокомолекулярным компонентом внеклеточного матрикса в некоторых тканях. В почке ГА присутствует в высокой концентрации во внутреннем мозговом слое и в очень низкой концентрации в коре. Кортико-медуллярный градиент ГА связан с повышением относительного количества бесклеточного промежуточного пространства, которое составляет до 10% почечной ткани в коре и до 20-30% во внутреннем мозговом слое. Преобладающее количество ГА находится во внеклеточном пространстве, где средняя молекулярная масса этого крупного олигосахарида обычно составляет > 106 кДа.
Показано, что в некоторых условиях количество почечного ГА модулируется. Обнаружено, что во внутреннем мозговом слое количество ГА повышается (от изначально высокого уровня) при продолжительном водном диурезе и односторонней непроходимости мочеточника у крыс, а также при быстром наборе веса, связанном с диетой, у собак и кроликов. В коре практически все экспериментальные воспалительные кровоизлияния вызывают обильное накопление ГА. Примеры можно найти в отторжении почечных аллотрансплантатов, острой почечной ишемии и промежуточно-тканевом нефрите. Часто утверждают, что во время воспаления ГА-фрагменты малой молекулярной массы образуются в тканях одновременно с повышенным накоплением ГА, но лишь немногие исследования убедительно подтверждают наличие олигомеров ГА в поврежденных органах, хотя ГА меньшего размера присутствовал в некоторых тканевых жидкостях. Механизмы генерации коротких ГА полимеров in vivo пока не ясны. Возможно, ГА меньшей молекулярной массы образуются под действием специфических ГА-синтаз или являются результатом ГА-деполимеризующей активности специфических для воспаления гиалуронидаз и активных форм кислорода. Природу и регуляцию этих ГА-метаболизирующих активностей в почке еще предстоит изучить.
Другой замечательной чертой почечного метаболизма ГА является его причастность к процессам почечного концентрирования и разбавления. В 1958 году русский физиолог Гинетзинский разработал модель антидиуретического действия вазопрессина, которая включала в себя высвобождение гиалуронидазы из клеток собирательных трубочек. Считалось, что последующее исчезновение ГА связано с облегчением реабсорбции и течения по промежуточному матриксу почки. Хотя заключение Гинетзинского о механизме действия вазопрессина в скором времени было отвергнуто, в более поздних экспериментах британских исследователей было обнаружено, что у крыс, получавших инъекции антител против почечной гиалуронидазы, но не против яичковой гиалуронидазы, была частично утрачена способность к концентрированию мочи. Эти замечательные исследования не получили продолжения.
замечательные исследования не получили продолжения. Вышеуказанные рассуждения побудили нас к исследованию почечного метаболизма ГА в различных условиях, связанных с механизмами почечного концентрирования и разбавления и с воспалительными почечными повреждениями. Кроме того, мы клонировали новый тип крысиной гиалуронидазы, названной Hyal-2, которая экспрессируется в почке в нормальных условиях и индуцируется различными воспалительными процессами.
Материалы и методы
Животные модели
У самцов и самок крыс Sprague-Dawley (Iffa Credo, Бельгия) весом 200-250 г вызывали обезвоживание (БВ) или повышенную водную нагрузку (ВН) в течение 3 дней. Обезвоживания добивались снижением ежедневного потребления воды до 5 мл; водной нагрузки достигали, предлагая крысам суточную порцию пищи (20 г), смешанную с водой (70 мл) и агаром (0.8 г), которую они потребляли полностью. Через 3 дня средние мочевые осмолярности составили 306±18 мосмоль/кгН2О у ВН крыс и 4564±290 мосмоль/кгН2О у БВ крыс (Р<0.001). Некоторые крысы получали повышенную водную нагрузку в течение 2 недель.
Серьезные нефротоксические повреждения были получены с помощью однократных инъекций 8 мг дихромата калия (K2Cr2O7) и 4 мг хлорида ртути (HgCl2) на кг массы тела в виде 1% водных растворов взрослым самцам крысы Wistar (Katholiek Universiteit van Leuven, Бельгия) весом 280-290 г. Контрольные крысы получали инъекции среды для лекарства. Масса тела и физическое состояние наблюдали от 2 до 4 недель. Некоторым крысам провели унинефрэктомию через 2 недели, остальным провели фиктивную операцию. Для определения степени почечной гипертрофии, вызванной экспериментами, почки удалили из умертвщленных животных, лиофилизовали в течение 48 часов, растерли в ступке и растворили в 1N NaOH в течение 48 часов, после чего определили содержание белка с использованием BioRad Protein Assay (по методу Брэдфорд).
Острые ишемические повреждения получали зажиманием левой почечной ножки у крыс Wistar в течение 45 минут под пентобарбитальной анестезией. Крысы были убиты 3 дня спустя, после чего левую и правую почку сравнили на содержание белков, воды, ГА и мРНК транскриптов Hyal-2 (см. ниже).
Определение почечных активностей ГА, гиалуронидазы и ГА-синтазы
Почки были быстро удалены из умертвщленных крыс, и небольшие фрагменты коры и внешнего и внутреннего мозговых слоев были мгновенно заморожены в жидком азоте. Образцы тканей лиофилизовали в течение 48 часов, аккуратно определив содержание воды (коэффициент вариации между измерениями <1 %). Высушенная ткань была обработана 3 мг/млПроназы Е (Sigma) при 55?С в течение 24 часов. После кипячения определили содержание ГА с использованием специфичного RIA-подобного метода (HA-50 Kit, Pharmacia-Amersham). Кроме того, определяли содержание мочевины (BUN Kit, Sigma) с тем чтобы выразить концентрации ГА на единицу сухого веса без мочевины, поскольку мочевина составляет значительную часть в массе мозгового слоя обезвоженных животных.
Активность гиалуронидазы определяли с помощью метода Reissig, как описано в литературе, в гомогенизированных образцах ткани в присутствии 1,4-лактона Д-сахарной кислоты (Sigma). Активность ?-глюкуронидазы измеряли по методу де Дьюва.
Для определения активности ГА-синтазы небольшие частицы коры и мозгового слоя разрушили ультразвуком 3 х 15 секунд и центрифугировали при 800 х g, 4?C, в течение 5 минут. Надосадки центрифугировали при 20,000 х g, 4?C в течение 20 минут. Осадки растворили в 100 мкл буфера (NaH2PO4 40 мМ, MgCl2 2мМ, рН 7.0), содержащего 5 мМ АТФ, 0.4 мМ УДФ-глюкозамина (Sigma) и 0.2 мкКи 14С-УДФ-глюкуроновой кислоты (Phaemacia-Amersham). Инкубировали в течение 1 часа при 37?C, после чего добавили 10 мкл 20% додецилсульфата натрия и немедленно вскипятили. Добавили холодный ГА (5 мг/мл) и продукты подвергли нисходящей бумажной хроматографии на фильтровальной бумаге Whatman #3 MM в изомасляной кислоте:NH4OH 1М 5:3 по объему в течение 48 часов. Полосы вырезали и оценили в сцинтилляционном составе Lumasafe Plus (Lumas-LSC, Нидерланды).
Определение молекулярной массы ГА во внутреннем мозговом слое
Образцы ткани внутреннего мозгового слоя, приготовленные, как описано выше, объединили и аликвоты по 1 мл нанесли на 16х1000-мм колонку Sephacryl S1000 Superfine (Pharmacia), элюировали буфером 1М NaCl, 0.05 M ацетата натрия, рН 6.0 на скорости 0.08 мл/мин. Стандартные ГА высоких молекулярных масс (любезно предоставленные Др. Виком и Др.Карам-Лелам, Pharmacia&Upjohn, Швеция) были йодированы 125I в соответствии с опубликованной методикой и использовались для калибрования колонки. Фракции по 2 мл собирали и исследовали на содержание 125I и/или ГА.
Клонирование кДНК крысиной гиалуронидазы Hyal-2
Для клонирования почечной гиалуронидазы мы провели полимеразную цепную реакцию (ПЦР) с использованием обратной транскриптазы на мозговой мРНК с использованием вырожденных олигонуклеотидов на основе консервативных областей гиалуронидазы спермы. Мы получили фрагмент длиной 350 н.п. и использовали его для скрининга библиотеки ?gt10 крысиной почечной кДНК (ClonTech, США). Был восстановлен клон кДНК длиной 1.9 т.н.п, кодирующий белок 473-АА, и секвенирован методом дидеокси-терминации (ABI Prism Dye Terminator Cycle Sequencing, Perkin-Elmer Corp.). Вычисленную последовательность поместили в GenBank под №AF034218. Эта кДНК кодирует крысиный белок Hyal-2 - особую форму гиалуронидазы, которая изначально была описана Леппердингером и др. у человека. На АА уровне крысиная Hyal-2 на 89 и 82% идентична человеческому и мышиному эквивалентам, и на 40% идентична человеческой Hyal-1.
Конкурирующая ПЦР мРНК транскриптов Hyal-2 с использованием обратной транскриптазы
Для определения количества мРНК Hyal-2 в различных тканях крысы использовали метод РНК-конкурирующей ПЦР с использованием обратной транскриптазы. Hind III/BamH I фрагмент кДНК крысиной Hyal-2 вставили в вектор pBlueScript и обработали ферментами Acc I/EcoR I, получив делецию длиной 50 н.п. в участке 595-645 н.п. С помощью Т7 РНК полимеразы (Promega) синтезировали конкурентную РНК, которую тщательно очистили и оценили количественно. Обратная транскрипция использовалась для синтеза одноцепочечной кДНК из общего количества РНК образцов почки в присутствии повышающегося количества конкурентной кРНК с использованием специфичного обратного праймера (GGCCGCTGTCCTGACGTGG) и обратной транскриптазы Expand (Roche). Продукты ПЦР-реакции, полученные с помощью прямого (GTGCACACCTGCCCATGCTG) и обратного праймеров, разделили методом электрофореза в 2% агарозном геле, окрасили бромидом этидия и количественно оценили методом цифровой обработки изображения с использованием программного обеспечения Scion Image (National Institutes of Health, США).
Экспрессия Hyal-2 в клетках насекомых Sf9
Клонировав крысиную Hyal-2, мы приняли решение экспрессировать ее кДНК в одном из немногих клеточных типов, не обнаруживающих гиалуронидазной активности, как следует из данных зимографии и других высокочувствительных методов. Клетки насекомых Sf9 оказались наиболее подходящими. КДНК Hyal-2 ввели в бакуловирусную систему и клетки Sf9 инфицировали рекомбинантным вирионом либо вирионом дикого типа, как описано в литературе.
Действие рекомбинантной Hyal-2 на стандартные ГА
Среды, в которых культивировались клетки Sf9, инфицированные рекомбинантным вирионом либо вирионом дикого типа, отдиализовали, сконцентрировали (Centriprep 30, Amicon) и инкубировали с пуповинным ГА (Sigma) при 37?С, рН 6.0, на ночь. Расщепленные образцы ГА разделили методом электрофореза в агарозных гелях в соответствии с методом Ли и Каумана. ГА из свиной кожи со средней молекулярной массой 40,000 Да (Seigakagu Corp.) использовали для сравнения.
Результаты и обсуждение
Измерения почечного ГА, гиалуронидазы и ГА-синтазы в ВН и БВ крысах показаны на рисунке 1. Они подтверждают наличие значительного кортико-медуллярного градиента ГА, который не соответствует изменениям ферментативной активности, связанным с метаболизмом ГА. Активность ?-глюкуронидазы была примерно одинакова во всех областях почки и при всех экспериментальных условиях (данные не показаны). Единственное значительное различие между крысами ВН и БВ имелось во внутреннем мозговом слое, где увеличилось количество гиалуронидазы и уменьшилось количество ГА-синтазы в связи с повышенной водной нагрузкой. Это позволяет предположить, что оба фермента могут принимать участие в возрастающей регуляции содержания мозгового ГА при повышенной водной нагрузке. Обнаружение факторов, модулирующих активность этих ферментов, и выяснение потенциальной роли антидиуретического гормона представляет особый интерес.
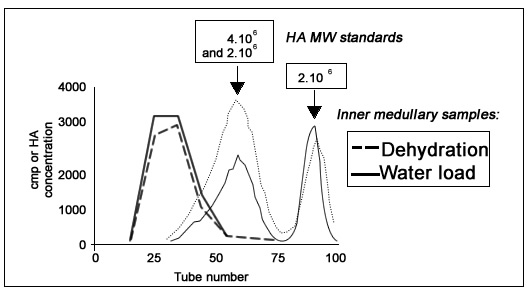
Молекулярную массу почечного ГА можно определить в образцах из внутреннего мозгового слоя, но не в образцах из внешнего мозгового слоя коры. Как показано на Рис. 2, элюция ГА внутреннего мозгового слоя происходила раньше стандартных ГА молекулярных масс (4 х 106, 2 х 106 и 2 х 105 Да), следовательно, его молекулярная масса составляет > 4 х 106 Да. Возможно, хотя и с меньшей вероятностью, что вторичная структура ГА, выделенного из внутреннего мозгового слоя, значительно отличается от вторичной структуры очищенных стандартных ГА. Во всяком случае, результаты измерения образцов из внутреннего мозгового слоя крыс ВН и БВ были практически одинаковы. Для меньших фрагментов ГА данные отсутствуют.
Иллюстрация 1. Измерения содержания ГА и активности гиалуронидазы и ГА-синтазы (ГАС) в различных частях почки обезвоженных крыс или крыс с повышенной водной нагрузкой. С, кора; ОМ, внешний мозговой слой; IМ, внутренний мозговой слой; IM-3 и IM-4, образцы из крыс с повышенной водной нагрузкой в течение 3 или 14 дней. Различия в IM статистически значимы (Р<0.01, ANOVA).
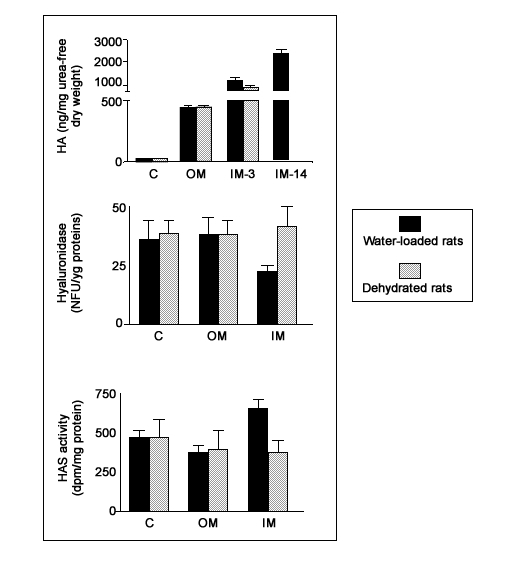
Иллюстрация 2. Определение молекулярной массы ГА во внутреннем мозговом слое обезвоженных крыс и крыс с повышенной водной нагрузкой с использованием колонок Sepharyl S1000. Положение стандартных ГА известных молекулярных масс приведены для сравнения.
Пост-ишемические и токсические почечные повреждения способствовали чрезвычайному увеличению содержания ГА в коре. Через 3 дня после зажимания почечной артерии уровень ГА в коре возрос более чем в 10 раз, от 6.8 ± 1.3 мкг/г сухого веса в контралатеральной почке до 81.7 ± 10.7 мкг/г в поврежденной почке (n = 9; Р<0.005). Одновременно возросло содержание воды от 75.2 ± 0.5% до 81.7 ± 0.6% (Р<0.001). Существует тесная корреляция между увеличением содержания воды, указывающим на отек ткани, и содержанием ГА (r = 0.71). Подобным образом, нефротоксическое повреждение вызывало повышение ГА в коре от 3.7 ± 0.2 до 73.3 ± 21.5 (n = 4) и до 71.1 ± 12.6 мкг/г (n = 5) спустя 2 и 4 недели, соответственно. По увеличению общего количества белка (+ 65.5 % и + 32.8 % спустя 2 и 4 недели) было определено, что накопление ГА в коре тесно связано со степенью тканевого отека (r = 0.77), но не со степенью гипертрофии почки. Еще одним методом получения почечной гипертрофии является унинефрэктомия. Однако, спустя 2 недели после процедуры, в оставшейся почке не наблюдалось повышения концентрации ГА (данные не показаны). Нефрэктомия, проведенная спустя 2 недели после токсических инъекций, выявила резкое проявление почечной гипертрофии (содержание белка возросло до 16.5 %) и при этом значительное (P<0.01) уменьшение отека коры (до 78.0 ± 1.0 % воды) и содержания ГА (до 45.7 ± 4.4 мкг/г) в оставшейся почке по сравнению с почками, подвергавшимися только воздействию нефротоксинов. В целом, нефротоксические почечные поражения, а также пост-ишемические повреждения вызывают соответствующее повышение уровня промежуточно-тканевой жидкости и накопления ГА в коре, в отличие от гипертрофии, вызванной унинефрэктомией. Хотелось бы верить в наличие причинной связи между накоплением ГА и воды.
Известно, что человеческая Hyal-2 расщепляет высокомолекулярный ГА на меньшие фрагменты. Клонировав крысиную Hyal-2 (см. Материалы и методы), мы определили регуляцию мРНК транскриптов Hyal-2 в коре и мозговом слое почки методом конкурирующей ПЦР с использованием обратной транскриптазы. Различное потребление воды не вносило изменений в количество мРНК Hyal-2, выраженной в 106 молекул/мкг общего количества РНК, в коре (17.3 ± 0.5 у крыс с повышенной водной нагрузкой против 18.6 ± 3.5 у обезвоженных крыс) или во внутреннем мозговом слое (6.3 ± 3.1 [BH] против 7.4 ± 1.1 [БВ]). С другой стороны, вследствие как пост-ишемического повреждения, так и нефротоксического поражения уровень мРНК Hyal-2 в коре приблизительно удваивался по сравнению с контрольными почками (от 5.8 ± 2.5 до 14.2 ± 3.2, и от 9.0 ± 2.0 до 18.8 ± 3.6, соответственно). Таким образом, индукция Hyal-2 при различных почечных заболеваниях может служить важным фактором реакции обратного провоспалительного ответа, приводящего к хроническим поражениям почек и включает взаимодействие ГА с его основным рецептором CD44.
Для исследования роли Hyal-2 в генерации провоспалительных ГА фрагментов мы экспрессировали ее кДНК в клетках Sf9 по методике с использованием бакуловирусов. Как показано на Рис. 3, рекомбинантная крысиная Hyal-2 расщепляет высокомолекулярный ГА на меньшие фрагменты. Методика с использованием агарозного геля не позволяет вычислить точный размер этих фрагментов, но, несомненно, их средняя молекулярная масса составляет < 40,000 Да. Кроме того, недавно мы показали, что ГА фрагменты, полученные с помощью рекомбинантной Hyal-2, способны активировать продукцию NO крысиными альвеолярными макрофагами (данные не показаны) подобно другим полидисперсным препаратам ГА, использованным другими исследователями.
Заключение
При повышенной водной нагрузке ГА чрезвычайно высокой молекулярной массы накапливается во внутреннем мозговом слое. Таким образом, этот полимер способен ограничивать транспорт воды через промежуточный матрикс и участвовать в механизме разбавления мочи. Модуляции активности некоторых типов ГА-синтазы и гиалуронидазы могут участвовать в этой регуляции. С другой стороны, пост-ишемические и токсические почечные повреждения вызывают накопление ГА в коре, одновременно индуцируя транскрипцию специфической гиалуронидазы Hyal-2, расщепляющей ГА на провоспалительные фрагменты среднего размера.
Иллюстрация 3. Агарозный гель-электрофорез продуктов расщепления рекомбинантной Hyal-2. Полосы 4 и 5 содержат нерасщепленные пробы ГА из свиной кожи (4) и человеческой пуповины (5). Остальные полосы содержат пуповинный ГА, инкубированный с возрастающим количеством культуральной среды от клеток Sf9 дикого типа (полосы 1-3) или инфицированных вирионами с рекoмбинантной Hyal-2. Под действием рекомбинантной Hyal-2 образуются ГА фрагменты со средней молекулярной массой < 40,000 Да, составляющей среднюю молекулярную массу ГА из свиной кожи.

Благодарности
Мы признательны К.Дельману, Дж.Лакремансу и Ж..Дегуссу за квалифицированную техническую поддержку. Крысы для нефротоксических поражений были подготовлены Р.Секкат (Университет Монс-Хайнот). Стандартные ГА определенных молекулярных масс были любезно предоставлены Др. Виком и Др. Карам-Лелам (Pharmacia & Upjohn, Швеция).