Абстракт
Гиалуронан (ГА) является широко распространенным несульфатированным гликозаминогликаном, выполняющим многочисленные физиологические и биологические функции, включая стимуляцию пролиферации и миграции клеток. Накопление ГА во внеклеточном матриксе происходит на ранних этапах восстановления тканей; кроме того, появление и исчезновение ГА в специфических участках четко контролируется во время эмбриогенеза. Регенерация печени после частичной гепатэктомии (ЧГ) является хорошо разработанной моделью in vivo для изучения пролиферации клеток и реорганизации тканей. В связи с этим мы изучали распределение ГА в тканях, его содержание в сыворотке, а также характер экспрессии генов ГА синтаз (ГАС1, ГАС2, ГАС3) в регенерирующейся печени крысы после гепатэктомии. В регенерирующейся печени происходило кратковременное синусоидальное накопление ГА начиная с 24 часов и до 48 часов после ЧГ. В норме ГА присутствует в кровотоке в низких концентрациях, но во время регенерации печени концентрация ГА в сыворотке кратковременно увеличивалась аналогично накоплению ГА в тканях. Полуколичественный анализ методом ПЦР с использованием обратной транскриптазы продемонстрировал увеличение уровня экспрессии ГАС1 в регенерирующейся печени вскоре после гепатэктомии, и сохранение его на столь высоком уровне в течение 1 недели. Временное накопление и синтез ГА может играть важную роль в регенерации печени путем преобразования микроокружения печени.
Ключевые слова
Печень, регенерация, сыворотка, гиалуронан, биотинилированный- HABP, ГАС1,2,3, ПЦР с использованием обратной транскриптазы
Введение
ГА является высокомолекулярным несульфатированным гликозаминогликаном, повсеместно распространенным во внеклеточном матриксе и выполняющим многочисленные физиологические и биологические функции, включая поддержание водного и плазменного белкового гомеостаза, стимуляцию клеточной пролиферации и миграции.
Распад ГА происходит локально в тканях; кроме того, он выделяется в лимфу и попадает в лимфатические узлы – важные участки катаболизма. Избыточное количество ГА из лимфатических узлов попадает в кровоток и захватывается печенью, эндотелиальные клетки которой отвечают за деградацию. В норме, ГА присутствует в кровяном русле в низких концентрациях, но при некоторых заболеваниях уровень ГА повышается.
Хорошо известно, что печень обладает замечательной способностью к регенерации. Хиггинс и Андерсон разработали простой метод ЧГ, позволяющий изучать изменения структуры, состава и функции оставшейся части печени. В данной работе мы исследовали кратковременное субсинусоидальное накопление ГА во время регенерации печени. Кроме того, были определены концентрации ГА в сыворотке и уровень экспрессии ГАС1, ГАС2 и ГАС3 в оставшейся части печени в разные промежутки времени после ЧГ.
Материалы и методы
Частичная гепатэктомия
Во всех экспериментах использовали самцов крыс Sprague-Dowley (SLC, Shizuoka, Япония) весом 180-200 г. Животных содержали в комнате с контролируемым температурным режимом и 12-часовым чередующимся суточным циклом. Животные прошли акклиматизацию до начала экспериментов. Крысам провели частичную гепатэктомию по методу Хиггинса и Андерсона под кислородно-эфирной анестезией.
Иммуногистохимия
Иммуногистохимическое окрашивание было проведено, как описано ранее. Вкратце, крыс умертвили под мягкой эфирной анестезией путем обескровливания через сонную артерию. Печень нарезали на блоки (3х3х3 мм), промыли в фосфатном буфере (PBS) и немедленно зафиксировали в 10% формалине и заключили в парафин. Срезы ткани печени толщиной 4 мкм получили с помощью микротома. Удалили воск из парафиновых секций с помощью ксилена и регидрировали в этаноле и фосфатном буфере. Эндогенную пероксидазную активность нейтрализовали выдерживанием тканей в 0.3% растворе H2O2 в метаноле в течение 30 минут. Неспецифическое связывание биотинилированного HABP заблокировали выдерживанием в 10% растворе БСА в фосфатном буфере в течение 10 минут. Для изучения специфичности биотинилированного HABP, контрольные срезы покрыли каплей гиалуронидазы streptomyces (EC4.2.2.1, Seikagaku Corp., Токио, Япония) в концентрации 1 ед/мл в 0.1 М фосфатном буфере, рН 5.0, содержащем 0.15 М хлорида натрия, 1мМ ЭДТА, 1мМ йодоуксусной кислоты, 1мМ PMSF и 1 мкг/мл пепстатина А во влажной камере и инкубировали при 37°С в течение 30 минут. После отмывки в фосфатном буфере, срезы инкубировали в течение 1 часа при комнатной температуре во влажной камере с биотинилированным HABP (1 мкг/мл) в фосфатном буфере. Срезы отмыли в фосфатном буфере, после чего инкубировали с раствором стрептавидина, конъюгированного с пероксидазой хрена (1:500), в фосфатном буфере в течение 30 минут при комнатной температуре во влажной камере. После дальнейшей отмывки фосфатным буфером, проявили цвет с помощью 50 мМ Tris-HCl, pH 7.4, содержащим 0.4 мг/мл тертагидрохлорида диаминобензидина. Все иммуногистохимические исследования проводили триплетами на двух или трех животных, прошедших ЧГ.
Иммуноэлектронная микроскопия
Ткани печени нарезали на блоки 1х1х1 мм и погрузили в раствор периодата-лизина-параформальдегида при 4°С на ночь. Криостатные срезы приготовили из фиксированных тканей и инкубировали с биотинолированным HABP в течение 1 часа и с HRPO-конъюгированным стрептавидином. После этого срезы зафиксировали в 1.5% глутаровом альдегиде, инкубировали в диаминобензидиновой среде, зафиксировали в OsO4 и заключили в Epon. Ткани нарезали с помощью ультрамикротома с алмазным ножом на срезы толщиной 60-80 нм, собрали на медную сетку с 200-нм ячейками и перекрасили цитратом свинца. Срезы тканей изучали и фотографировали с помощью трансмиссионного электронного микроскопа Hitachi H-7000.
Исследование методом IBA для оценки количественного содержания ГА
В работе применяли метод IBA, заимствованный из метода, описанного Фосангом и др. Вкратце, 96-луночные планшеты с раствором ГА-БСА (10 мкг/мл) оставили на ночь при 4°С, трижды промыли фосфатным буфером. В лунки добавили раствор 1% БСА в фосфатном буфере, инкубировали при комнатной температуре в течение 2 часов, после чего трижды промыли фосфатным буфером, содержащим 0.05% Tween-20 (T-PBS). 50 мкл разведенного образца или стандартного раствора, приготовленного на T-PBS, поместили в лунки и добавили раствор биотинилированного HABP (1 мкг/мл) и инкубировали при 37°С в течение 1 часа. После промывки лунок, как описано выше, добавили раствор HRP-конъюгированного авидина Д (1 мкг/мл) и инкубировали в течение 1 часа. Лунки снова промыли, добавили раствор субстрата, содержащий OPD и Н2О2, и инкубировали в течение 30 минут. Реакцию остановили добавлением 1М HCl и измеряли поглощение при 492 нм на планшетном ридере. Концентрации ГА в образце сыворотки вычисляли по калибровочной кривой, полученной с помощью стандартного ГА (30 кДа). Анализ ненасыщенных тетрасахаридов и гексасахаридов ГА методом жидкостной хроматографии высокого давления (HPLC) проводили по методам Таказоно и др. и Шинмея и др.
Полуколичественная полимеразная цепная реакция с использованием обратной транскриптазы/Southern для изучения экспрессии ГАС
Общее количество РНК выделили из образца ткани регенерирующейся печени крысы с использованием реагента TRIZOL (LIFE TECHNOLOGIES, Rockville, MD) по методике, рекомендованной производителем. Для оценки экспрессии ГАС, исследовали общее количество РНК из регенерирующейся печени крысы методом ПЦР с использованием обратной транскриптазы. Обратную транскрипцию проводили с использованием олиго-dT праймеров и обратной транскриптазы SuperScript II РНКазы Н (LIFE TECHNOLOGIES, Rockville, MD) по методике, рекомендованной производителем. ПЦР реакцию проводили на ПЦР Системе GeneAmp модель 2400 (Perkin Elmer Japan, Япония) в следующих условиях: 30-40 циклов при 94°С в течение 1 минуты, 57°С в течение 1 минуты, 72°С в течение 1 минуты и 72°С в течение 10 минут. Специфические праймеры для ПЦР анализа были следующие:
ГАС1 (S: CTTGTCAGAGCTACTTCCACTG, A: CGGACTCATACTTGGACACGTT),
ГАС2 (S: TGCAGTTTCGGTGATGATAGGC, A: TGTCGGGTTCACTCTCACTTTC),
ГАС3 (S: CCACACAGAAAAGCACTACCTG, A: GAATGGGAAGAAACCTGTGAAC), GAPDH (S: GCATGGCCTTCCGTGTTCCTAC, A: GTCCACCACCCTGTTGCTGTAG).
Продукты ПЦР исследовали методом электрофореза в 2.0 % (w/v) агарозном геле, после чего перенесли на нейлоновую мембрану. После гибридизации с 32Р-меченым каждого ПЦР-фрагмента, индивидуальность которого была подтверждена прямым секвенированием, мембрану отмыли и изучали с помощью системы анализа изображения BAS2000 (FujiFilm, Япония).
Результаты и обсуждение
Кратковременное субсинусоидальное накопление ГА в регенерирующейся и неонатальной печени крысы
Во время контроля изменений во внеклеточном матриксе регенерирующейся печени крысы в разные промежутки времени после ЧГ, наблюдалось значительное повышение накопления ГА в ткани спустя 12 часов после гепатэктомии. Накопление увеличивалось до 48 часов, после чего постепенно снижалось и не определялось спустя 2 недели (Рис. 1). В неонатальной печени происходит активный рост незрелых гепатоцитов по аутокринному механизму. Окрашивание на ГА у животных разных возрастов показало незначительное накопление ГА в перисинусоидальном пространстве до рождения, которое значительно увеличивалось после рождения. На ранней постнатальной стадии наблюдалось интенсивное окрашивание ГА в перисинусоидальном пространстве во всей дольке печени, и очень слабое окрашивание спустя 1 день жизни крысы. Накопление ГА постепенно повышается после рождения и достигает максимума у крыс на первой неделе жизни, после чего снижается спустя 2 недели после рождения; в возрасте 7 недель в перисинусоидальном пространстве определяются лишь следы ГА. Эти результаты позволяют предположить, что накопление ГА происходит кратковременно на раннем этапе регенерации и неонатального развития печени, а также является необходимым для пролиферации гепатоцитов. Кратковременное накопление ГА в регенерирующейся печени может быть повторным возникновением эмбрионального микроокружения печени.
Наблюдения методом трансмиссионной электронной микроскопии показали, что кратковременное субсинусоидальное накопление ГА наблюдается в пространстве Диссе, между эндотелиальными клетками и гепатоцитами. Это позволяет предположить, что такое расположение способствует формированию локального микроокружения печени.
Иллюстрация 1. Кратковременное накопление ГА в регенерирующейся печени крысы.
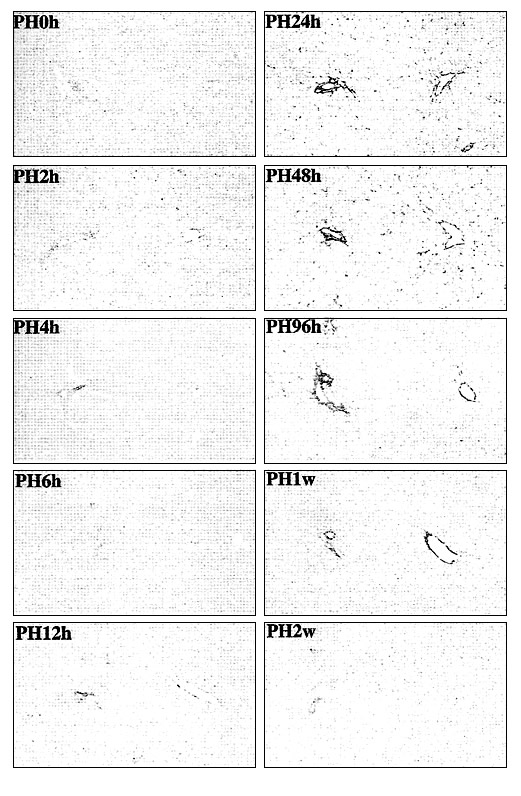
Иллюстрация 2. Кранковременног повышение концентрации ГА в сыворотке во время регенерации печени.
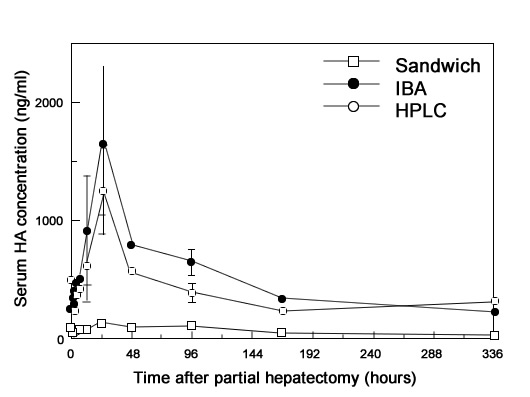
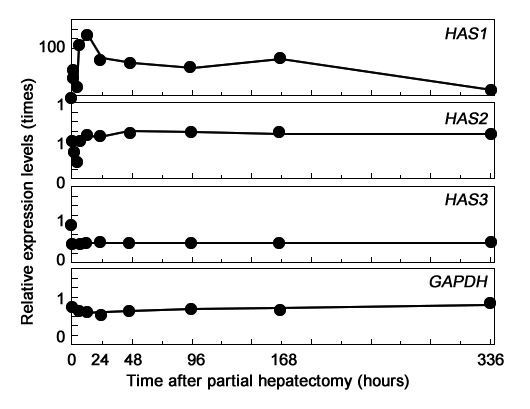
Иллюстрация 3. Экспрессия ГАС во время регенерации печени.
Кратковременное повышение концентрации ГА в сыворотке во время регенерации печени
Хорошо известно, что накопление ГА во внеклеточном матриксе происходит на раннем этапе восстановления тканей. Печень является главным органом, в котором удаляется ГА из кровяного русла. В норме уровень ГА в сыворотке очень низок благодаря быстрому и эффективному рецептор-опосредованному эндоцитозу эндотелиальными клетками печени. Таким образом, поскольку мы посчитали сывороточный ГА источником субсинусоидального ГА, мы исследовали уровень ГА в сыворотке методом IBA.
Исследование содержания ГА в плазме у гепатэктомизированных крыс в разные промежутки времени после гепатэктомии тремя методами (IBA, HPLC, Sandwich) показало, что содержание ГА по оценке методами IBA и HPLC резко возросло и достигло максимального значение спустя 24 часа после гепатэктомии (Рис. 2). Возвращение к нормальному содержанию в плазме наблюдалось спустя 1 и 2 недели после операции и совпало со временем возвращения печени к нормальным размерам. Исследование методом Sandwich показало снижение чувствительности к сывороточному ГА.
Сывороточный ГА определялся в широком диапазоне молекулярных масс, причем максимальное содержание наблюдалось при молекулярной массе 35 кДа при исследовании методом GPC-HPLC. Этот результат хорошо объяснил причину меньшей эффективности метода Sandwich по сравнению с методом IBA для сывороточного ГА.
Кратковременное повышение уровня экспрессии ГАС1 во время регенерации печени
Для исследования другого механизма накопления ГА – локального синтеза – мы изучали относительный характер экспрессии ГАС1, ГАС2 и ГАС3 методом полуколичественной ПЦР с использованием обратной транскриптазы/Southern со специфическими праймерами (Рис 3). Базальный уровень экспрессии ГАС1 в печени был очень низким. Но после ЧГ, уровень экспрессии значительно возрос на самой ранней стадии регенерации печени по двухфазному механизму. Первый пик наблюдался через 2 часа, второй пик через 12 часов после ЧГ, в 55 раз и 116 раз превышая базальный уровень экспрессии, соответственно. После этого уровень экспрессии стал постепенно снижаться и вернулся к базальному значению спустя 2 недели. Базальный уровень экспрессии ГАС2 был достаточно низким. После ЧГ, уровень экспрессии в 0.46 раз от базального уровня спустя 4 часа и вскоре вернулся к исходному уровню, на котором держался в течение 2 недель. Базальный уровень экспрессии ГАС3 был ничтожным. В качестве контроля использовали GADPH. В данной работе мы показали кратковременное субсинусоидальное накопление ГА на ранней стадии регенерации печени после ЧГ. Одновременно с накоплением, содержание сывороточного ГА и уровень экспрессии ГАС1 повышались по аналогичной временной модели.
В последние два десятилетия возросло понимание молекулярных механизмов контроля роста печени при регенерации с помощью различных факторов роста и цитокинов. Все эти факторы играют важную роль в координации регенерации печени. Однако было хорошо известно, что в норме гепатоциты не готовы к ответу на эти митогенные сигналы в отсутствие ряда предшествующих событий, которые переводят их в чувствительное состояние. С другой стороны, более ранние исследования показали, что при объединении крыс в пары путем парабиосферного обращения, гепатэктомия одного члена пары вызывает регенерацию интактной печени другого члена. Эти исследования являются убедительным доказательством того, что митогенные сигналы гепатоцитам появляются в кровяном русле при регенерации печени и также являются эффективными для пролиферации в нормальной печени. Конечно, существует множество факторов роста, цитокинов, протеаз и протеазных ингибиторов в кровяном русле, но сывороточный ГА или гуморальные факторы, индуцирующие экспрессию ГАС1, также могут играть важную роль для запуска этих событий. Они также могут участвовать в накоплении ГА в субсинусоидальном пространстве и преобразовывать матрикс в благоприятное для роста микроокружение печени.
Выводы
Перисинусоидальное накопление ГА, наблюдаемое в пространстве Диссе при регенерации печени, может быть связано с повышенным содержанием ГА в сыворотке и увеличением уровня экспрессии ГА.