Этот раздел обсуждает in vitro и in vivo применения гидрогелей в тканевой инженерии хряща. Впоследствии будет рассмотрен обзор ключевых факторов, необходимых для комбинирования живых клеток с полимерами гидрогеля и экспериментальные применения гидрогелей. Инкапсуляция клеток внутри гидрогелей представляет собой уникальный метод изучения тканевой инженерии хряща. Раздел содержит обзор обычно используемых материалов, как для природных, так и для синтетических гидрогелей (табл. 3.1).
Таблица 3.1. Природные и синтетические полимеры, обычно используемые в синтезе гидрогелей (Peppas et al., 2000; Varghese and Elisseeff, 2006)
|
Природные гидрогели |
Синтетические полимеры |
|
гиалуроновая кислота |
гидроксиэтил метакрилат
Hydroxyethyl methacrylate (HEMA) |
|
хондроитин сульфат |
метаоксиэтил метакрилат
Methoxyethyl methacrylate (MEMA) |
|
матригель |
А/-винил-2-пирролидон
A/-vinyl-2-pyrrolidone (NVP) |
|
альгинат |
АМсопропил Аам
AMsopropyl Aam (NIPAAm) |
|
коллаген |
акриловая кислота
Acrylic Acid (AA) |
|
фибрин |
полиэтиленгликоль акрилат
Poly(ethylene glycol) acrylate (PEGA) |
|
хитозан |
полиэтиленоксид диакрилат
Poly(ethylene oxide) diacrylate |
|
шелк |
полиэтиленгликоль диакрилат
(poly(ethylene glycol) diacrylate (PEGDA)) |
|
желатин |
поливинил алкоголь
Polyvinyl alcohol) (PVA) |
|
агароза |
полифумараты
Poly(fumarates) |
|
декстран |
Требования к инкапсуляции
Требования для инкапсуляции клеток в гидрогелях отличаются в опытах in vitro и in vivo. Потенциальный гидрогель должен соответствовать минимальным критериям для использования его в in vitro культуре: возможность поддерживать клеточную пролиферацию и фенотип, значительная пористость для желаемой клеточной плотности, а также для транспорта питательных веществ и метаболитов, и отсутствие токсичности самого материла, его приготовления и/или разрушения. In vivo операции требуют следующих качеств:
- Отсутствие токсичных материалов и продуктов распада, которые могут нанести вред организму реципиента или отдельным клеткам.
- Минимальный воспалительный и иммуногенный ответ на имплантируемый материал.
- Значительная структурная целостность для поставленных задач (подкожные имплантанты по сравнению с суставными заменами хряща).
Применение инкапсуляции клеток в гидрогели
Опыты in vitro
Подложки из гидрогелей играют несколько важных ролей в in vitro исследованиях по тканевой инженерии. Например, гидрогели, используемые для формирования контролируемого внеклеточного окружения для изучения объемных взаимодействий «клетка-клетка» и «клетка-матрикс». Для построения и синтеза конструируемых тканей со специфическими свойствами необходимо детальное знание взаимодействий клеток с другими клетками, биоактивными факторами и их микроокружением. Было отмечено, что некоторые типы клеток ( хондроциты ) дифференцируются в двумерной культуре ( von der Mark et al., 1977; Benya and Shaffer, 1982 ), в то время как сохранение их фенотипа поддерживается в объемной культуре ( Homicz et al., 2003 ). Действительно, существует интерес к объемным культурам человеческих хондроцитов, чтобы в дальнейшем использовать их в аутологичной трансплантации. При этом можно избежать или обратить дедифференцировку, наблюдаемую при культивировании в монослое ( Homicz et al., 2003 ).
Для улучшения генерации тканей гидрогели видоизменяли с помощью биоактивных факторов и белков клеточной адгезии. Несколько групп ученых доложили об увеличении пролиферации клеток, инкапсулированных в основу с добавлением белка клеточной адгезии RGD ( Rowley et al., 1999; Alsberg et al., 2001, 2002; Hsu et al., 2004 ). Lee et al. ( 2004а ) включил TGF-pl в хитозановую основу, в которой культивировались хондроциты. Хондроциты, растущие на подложках с содержанием TGF-pl, показывали больший уровень пролиферации и продукции GAG и коллагена II типа, по сравнению с хондроцитами, растущими на основе без TGF-pl.
Микроструктура подложки также оказывает влияние на культивируемые клетки. Фибриллярная микроструктура гидрогелей, синтезированных из самособирающихся синтетических олигопептидов, приблизительно в три раза меньше, чем у гидрогелей из синтетических полимеров, таких как PEO, полилактат амид ( poly(lactic acid) - PLA ) и полигликат амид ( poly(glycolic acid) - PGA ) и более близких веществ к ряду природных ECM ( Kisiday et al., 2002 ). Kisiday et al. ( 2002 ) культивировал хондроциты в синтетическом гидрогеле на основе пептидов ( KLD-12 ), сравнивая их пролиферацию, секрецию матрикса и механические свойства с общепринятыми хондроцит-агарозными основами. Хондроциты, культивируемые в пептидных гидрогелях, пролиферировали гораздо интенсивней, чем те, которые росли на агарозной подложке, хотя механические характеристики, гистологический вид и биохимический состав был одинаков.
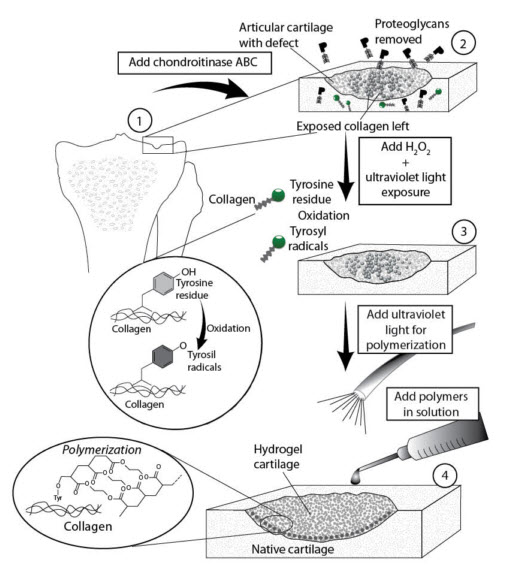
Рис. 3.2 Схематическое изображение интеграции гидрогелей в хрящ, вызванной фотополимеризацией. Отдельные этапы процесса представляют собой: этап 2, очистка суставного хряща от протеогликанов с помощью хондроитиназы - для обнажения коллагеновой сети; этап 3, in situ образование радикалов тирозила фото-окислением тирозиновых остатков на коллагене, при помощи Н2О2 под ультрафиолетовым облучением малой интенсивности; этап 4, введение раствора макромеров и in situ фотогелеобразование в следствие инициации тирозиловых радикалов и возбуждения ультрафиолетом (Wang et al., 2004). (Перепечатано с разрешения Wiley Interscience ©).
Опыты in vivo
Подложки из гидрогелей также широко используются в исследованиях тканевой инженерии in vivo. Обычно они используются как переносчики для клеток и/или ростовых факторов, а их первоначальной задачей является поддержка роста и развития здоровой ткани, а также интеграция в окружающие ткани. В этой связи подложки должны быть биосовместимы с тканями хозяина, не выделять токсичных веществ или не вызывать явного воспалительного ответа. В добавок ко всему, подложка должна иметь достаточную прочность и устойчивость к воздействиям в месте имплантации, без преждевременного распада. Использование гидрогелей in vivo в инженерии хрящевой ткани в настоящее время включает в себя имплантацию гидрогелевых подложек ( обычно подкожно ) для определения возможности генерации хрящеподобной ткани (рис. 3.2). С другой стороны, дефект хряща может быть создан после применения гидрогеле-хондроцитовых подложек для оценки излечения. Несколько научных групп показали наличие секреции хрящевого матрикса in vivo при использовании инкапсулированных хондроцитов в гидрогелях из фибрина (Westreich et al., 2004; Xu et al., 2004,2005); агарозы (Diduch et al., 2000), альгината (Paige et al., 1996; Alsberg et al., 2003; Chang et al., 2003; Kamil et al., 2004), хитозана (Chenite et al., 2000; Hoemann et al., 2005), гиалуроновой кислоты - HA (Dausse et al., 2003; Hsu et al., 2004; Nettles et al., 2004), и синтетических полимеров, таких как PLA, PGA и PEO (Elisseeff et al., 1999b; Mercier et al., 2004; Alhadlaq and Muo, 2005). Опять же, сложно делать обширные выводы о годности различных гидрогелей для тканевой инженерии вследствие большого разнообразия экспериментальных схем и подходов. Использование гидрогелей широко применяется для поддержки роста хондроцитов и продукции матрикса. В настоящее время исследования ведутся в направлении более широкого применения гидрогелей в клинике.